
| A. | 次氯酸的电子式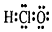 | B. | 二氧化硅的分子式:SiO2 | ||
| C. | 中子数为18的铝原子:1735Cl | D. | 钠离子的结构示意图: |
分析 A.次氯酸是以氧原子为中心的共价化合物;
B.二氧化硅是原子晶体;
C.质量数=质子数+中子数;
D.钠离子核外含有10个电子.
解答 解:A.次氯酸是以氧原子为中心的共价化合物,电子式为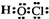 ,故A错误;
,故A错误;
B.二氧化硅是原子晶体,由硅原子和氧原子构成,不含分子,故B错误;
C.该氯原子的质量数为17+18=38,表示为1735Cl,故C正确;
D.钠离子的最外层电子数为8,钠离子的结构示意图为: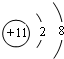 ,故D错误;
,故D错误;
故选C.
点评 本题考查了常见化学用语的判断,题目难度中等,注意掌握原子结构示意图与离子结构示意图、化学式、分子式等常见化学用语的概念及表示方法,试题侧重基础知识的考查,有利于培养学生灵活应用所学知识的能力.


科目:高中化学 来源: 题型:实验题
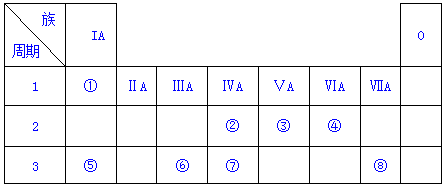
| 假设 | 实验操作 | 现象及结论 |
| 假设1:碳粉可用作还原剂,脱除硝酸盐 | 向烧杯中加入① 碳粉,一段时间后,测定烧杯中NO3-的浓度 | NO3-浓度无明显变化,说明假设Ⅰ不成立 |
| 假设2:碳粉、铁粉形成无数个微小的原电池,促进了硝酸盐的脱除 | 按图示组装实验装置,一段时间后,测定NO3-浓度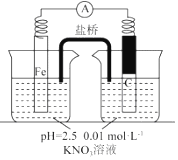 | ② Fe电极部分溶解,电流计指针偏转,说明假设2成立 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
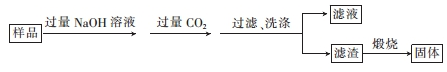
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 2.4g金属镁所含电子数目为0.2NA | |
| B. | 16gCH4所含原子数目为5NA | |
| C. | 17gNH3所含电子数目为10NA | |
| D. | 在常温常压下,11.2LN2含有的分子数为0.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若HA、HB均为弱酸,酸性:HA>HB,则相同条件下,溶液的pH大小为NaA>NaB | |
| B. | 相同条件下,将pH=11的NaOH溶液和和氨水分别稀释pH=9的溶液,所加水的体积前者大 | |
| C. | pH=3的醋酸与pH=1的NaOH溶液等体积混合时,溶液中离子浓度的大小顺序是:c(Na+)>c(CHCOO-)>c(OH-)>c(H+) | |
| D. | 0.1mol/L的某二元弱酸盐Na2A溶液中,c(Na+)=2[c(HA-)+c(A2-)+c(H2A)] |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯原子的结构示意图: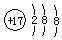 | B. | 甲烷分子的球棍模型: | ||
| C. | 氯化镁的电子式: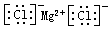 | D. | 原子核内有8个中子的氧原子:818O |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省高二上10月月考化学试卷(解析版) 题型:选择题
下列热化学方程式书写正确的是(△H的绝对值均正确)
A.C2H5OH(l)+3O2(g)==2CO2(g)+3H2O(g);△H=-1367.0 kJ/mol(燃烧热)
B.NaOH(aq)+HCl(aq)==NaCl(aq)+H2O(l);△H=+57.3kJ/mol(中和热)
C.S(s)+O2(g)==SO2(g);△H=-296.8kJ/mol(反应热)
D.2NO2==O2+2NO;△H=+116.2kJ/mol(反应热)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com