
分析 (1)气体为氢气,n=$\frac{11.2L}{22.4L/mol}$=0.5mol,结合电子及原子守恒计算;
(2)该Mg、Al的混合物与盐酸恰好完全反应,在滴加NaOH溶液过程中,欲使Mg2+、Al3+刚好沉淀完全,生成氢氧化镁、氢氧化铝,结合原子守恒计算.
解答 解:(1)体为氢气,n=$\frac{11.2L}{22.4L/mol}$=0.5mol,设Mg、Al的物质的量分别为x、y,则
$\left\{\begin{array}{l}{x+y=0.4}\\{2x+3y=0.5×2(1-0)}\end{array}\right.$
解得x=y=0.2mol,
答:该混合物中Mg、Al的物质的量均为0.2mol;
(2)该Mg、Al的混合物与盐酸恰好完全反应,在滴加NaOH溶液过程中,欲使Mg2+、Al3+刚好沉淀完全,生成氢氧化镁、氢氧化铝,且不发生HCl与NaOH的反应,
由原子守恒可知,n(NaOH)=2n(Mg)+3n(Al)=2×0.2mol+3×0.2mol=1mol,需要NaOH溶液的体积为$\frac{1mol}{4mol/L}$=0.25L=250mL,
答:滴入NaOH溶液的体积为250mL.
点评 本题考查氧化还原反应的计算,为高频考点,把握电子及原子守恒为解答的关键,侧重分析与计算能力的考查,注意守恒法的应用,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 分液时,分液漏斗下层液体从下口放出,上层液体从上口倒出 | |
| B. | 蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处 | |
| C. | 蒸馏中,冷却水应从冷凝管的下口通入,上口流出 | |
| D. | 过滤操作时,漏斗颈下端不能紧靠烧杯内壁 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 2W-+Z2═2Z-+W2 | B. | 2X-+Z2═2Z-+X2 | C. | 2Y-+W2═2W-+Y2 | D. | 2Z-+X2═2X-+Z2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
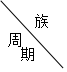 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | A | |||||||
| 2 | D | E | G | I | ||||
| 3 | B | C | F | H |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碱性锌锰干电池属于二次电池 | B. | △H3=△H1+△H2 | ||
| C. | 反应①的活化能为24.4 kJ•mol-1 | D. | △H1<△H3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用过量氨水吸收工业尾气中的SO2:2NH3•H2O+SO2═2NH4++SO32-+H2O | |
| B. | 氯化钠与浓硫酸混合加热:H++Cl-$\frac{\underline{\;\;△\;\;}}{\;}$HCl↑ | |
| C. | 磁性氧化铁溶于稀硝酸:3Fe2++4H++NO3-═3Fe3++NO↑+3H2O | |
| D. | 明矾溶液中滴入Ba(OH)2溶液使SO42-恰好完全沉淀:2Ba2++3OH-+Al3++2SO42-═2BaSO4↓+Al(OH)3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 方法I | 用炭粉在高温条件下还原CuO生成Cu2O和CO2 |
| 方法II | 用肼(N2H4)还原新制Cu(OH)2 |
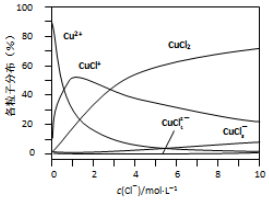
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 工厂排放 CO2会导致酸雨的形成 | |
| B. | 使用含有氯化钙的融雪剂会加速桥梁的腐蚀 | |
| C. | “山东疫苗案”涉及疫苗未冷藏储运而失效,这与蛋白质变性有关 | |
| D. | 《黄白第十六》中有“曾青涂铁,铁赤如铜”,这与化学变化有关 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com