
【题目】已知:
①CO(g)+![]() O2(g)===CO2(g) ΔH=-283.0 kJ·mol-1
O2(g)===CO2(g) ΔH=-283.0 kJ·mol-1
②H2(g)+![]() O2(g)===H2O(g) ΔH=-241.8 kJ·mol-1
O2(g)===H2O(g) ΔH=-241.8 kJ·mol-1
下列说法正确的是( )
A. 通常状况下,氢气的燃烧热为241.8 kJ·mol-1
B. 由①可知,1 mol CO(g)和![]() mol O2(g)反应生成 1 mol CO2(g),放出283.0 kJ的热量
mol O2(g)反应生成 1 mol CO2(g),放出283.0 kJ的热量
C. 可用下图表示2CO2(g)===2CO(g)+O2(g)反应过程中的能量变化关系
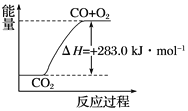
D. 分解1 mol H2O(g),其反应热为-241.8 kJ
【答案】B
【解析】
本题考查的是燃烧热和和热化学方程式的含义,根据定义进行分析即可。
A.燃烧热是指1mol可燃物完全燃烧生成稳定的氧化物时放出的热量,水的稳定状态为液态,故燃烧热不是241.8 kJ·mol-1,故错误;B.热化学方程式中的系数表示物质的量,所以CO(g)+![]() O2(g)===CO2(g) ΔH=-283.0 kJ·mol-1的含义为1 mol CO(g)和
O2(g)===CO2(g) ΔH=-283.0 kJ·mol-1的含义为1 mol CO(g)和 ![]() mol O2(g)反应生成 1 mol CO2(g),放出283.0 kJ的热量,故正确;C.反应为放热反应,但图像表示的为吸热反应,故错误;D.反应物和生成物相反,则反应热的符号改变,所以分解1 mol H2O(g),其反应热为+241.8 kJ,故错误。故选B。
mol O2(g)反应生成 1 mol CO2(g),放出283.0 kJ的热量,故正确;C.反应为放热反应,但图像表示的为吸热反应,故错误;D.反应物和生成物相反,则反应热的符号改变,所以分解1 mol H2O(g),其反应热为+241.8 kJ,故错误。故选B。


科目:高中化学 来源: 题型:
【题目】描述弱电解质电离情况可以用电离度和电离平衡常数表示,下表是常温下几种弱电解质的电离平衡常数:
酸或碱 | 电离常数(Ka或Kb) | 难(微)溶物 | 溶度积常数(Ksp) |
CH3COOH | 1.8×10-5 | BaSO4 | 1×10-10 |
HNO2 | 4.6×10-4 | BaCO3 | 2.6×10-9 |
HCN | 5×10-10 | CaSO4 | 7×10-5 |
HClO | 3×10-8 | CaCO3 | 5×10-9 |
NH3·H2O | 1.8×10-5 |
请回答下面问题:
(1)上述四种酸中,酸性最弱的是 (用化学式表示)。下列能使醋酸溶液中CH3COOH的电离程度增大,而电离常数不变的操作是(填序号)。
A.升高温度 B.加水稀释
C.加少量的CH3COONa固体 D.加少量冰醋酸
(2)CH3COONH4的水溶液呈 (选填“酸性”“中性”或“碱性”),理由是 , 溶液中各离子浓度大小的关系是。
(3)物质的量1∶1的NaCN和HCN的混合溶液,其pH>7,该溶液中离子的浓度从大到小排列为。
(4)工业中常将BaSO4转化为BaCO3后,再将其制成各种可溶性的钡盐(如:BaCl2)。具体做法是用饱和的纯碱溶液浸泡BaSO4粉末,并不断补充纯碱,最后BaSO4转化为BaCO3。现有足量的BaSO4悬浊液,在该悬浊液中加纯碱粉末并不断搅拌,为使SO42-物质的量浓度达到0.01mol·L-1以上,则溶液中CO32-物质的量浓度应 ≥mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】298K时,向20mL0.1mol·L-1MOH溶液中滴加0.1mol·L-1CH3COOH溶液,所得溶液的pH及导电能力变化如图所示。下列叙述正确的是( )
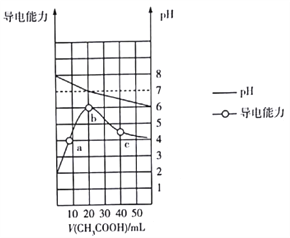
A. MOH是强电解质 B. b点对应的盐不水解
C. 水的离子积Kw:b>c>a D. c点溶液中c(CH3COO-)>c(M+)>c(H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在反应2SO2+18O22SO3中,其中氧气用18O标记上,其中含有18O的物质有( )
A.SO2
B.O2 、SO3
C.SO2 、 O2 、 SO3
D.SO2 、SO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F六种短周期元素在元素周期表中的位置如图所示。
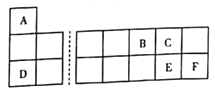
回答下列问题:
(1)在周期表中,E位于第_____________周期第_____________族。
(2)A、B能组成既含极性键又含非极性键的化合物,其电子式为_____________。
(3)在E、F的气态氢化物中,热稳定性较强的是_____________(填化学式,下同),还原性较强的是_______________。
(4)A、C、D、E组成两种酸式盐X、Y,将X、Y溶液混合发生复分解反应,写出离子方程式:________________________________________________________。
(5)常用(BA4)2E2C8检验废水中的Mn2+,若观察到无色溶液变紫红色,可判断废水中含Mn2+,还原产物与盐酸酸化的BaCl2溶液混合产生白色沉淀。写出无色溶液变紫红色溶液的离子方程式:_________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能源可分为一级能源和二级能源,自然界中以现成形式提供的能源称一级能源,需依靠其他能源的能量间接制取的能源称为二级能源.据此判断,下列叙述正确的是( )
A.天然气是二级能源
B.石油是二级能源
C.电能是一级能源
D.水力是一级能源
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是 ( )
A.Cl2是双原子分子,H2S是三原子分子,这是由共价键的方向性决定的
B.H2O与H2S的空间结构一样是由共价键的饱和性决定的
C.并非所有的共价键都有方向性
D.两原子轨道发生重叠后,电子在两核间出现的概率减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙醇和乙酸在生活和工业生产中用途广泛。请完成以下关于乙醇和乙酸的相关问题:
(1)乙醇是重要的燃料,已知在25℃、101kPa下,1kg乙醇充分燃烧能放出29713.04kJ热量,写出表示乙醇燃烧热的热化学方程式:_________________________________________。
(2)乙醇燃料电池应用前景乐观,以稀硫酸为电解质溶液,燃料电池的正极电极反应式为:__________。在负极除生成CO2外,还生成了极少量的乙酸,写出生成乙酸的电极反应式:_____________________________________。
(3)乙醇和乙酸反应可生成乙酸乙酯,反应方程式为:_______________________________。在密闭容器中,利用该反应制备乙酸乙酯,实验中若起始时在容器中加入3mol乙醇、1mol乙酸和一定量的浓硫酸,充分反应后容器中残留的乙醇可能为______________。
A.2mol B.2.6mol C.2.8mol D.3mol
(4)反应后可向反应混合物中加入_____________溶液,再用分液漏斗分离出乙酸乙酯。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将两根铁钉分别缠绕铜丝和铝条,放入滴有混合溶液的容器中,如图所示,下列叙述错误的是

A. b中铁钉附近呈现红色 B. a中铁钉附近呈现蓝色沉淀
C. b中发生吸氧腐蚀 D. a中铜丝附近有气泡产生
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com