
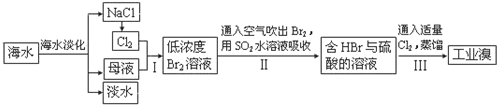
分析 (1)①除去SO42-选择BaCl2,除去Ca2+选择Na2CO3,除去Mg2+选择NaOH,但碳酸钠一定在氯化钡之后;
②氯气与石灰乳反应制备漂白粉;
(2)①步骤Ⅱ中又将Br2还原为Br-,二氧化硫与溴发生氧化还原反应;
②除去该产物中仍残留的少量Cl2,加入NaBr溶液,和氯气反应生成氯化钠和溴单质,达到除去氯气的目的,充分反应后,用萃取分液的方法分离.
解答 解:(1)①从海水中得到的粗盐中含Ca2+、Mg2+、SO42-等杂质离子,可以用试剂BaCl2溶液除去钡离子、用Na2CO3溶液除去钡离子、用NaOH除去镁离子、用HCl除去碳酸根离子,除杂时,应该先用氯化钡或氢氧化钠处于硫酸根离子或镁离子,加入这两种物质后再加入碳酸钠除去钙离子,过量的碳酸根离子用稀盐酸除去,所以加入试剂的合理顺序是BaCl2或NaOH→Na2CO3→过滤、盐酸,或BaCl2、Na2CO3、NaOH、过滤、盐酸,只有c不符合,故答案为:c;
②氯气与石灰乳反应制备漂白粉,反应为2Cl2+2Ca(OH)2═CaCl2+Ca(ClO)2+2H2O,故答案为:2Cl2+2Ca(OH)2═CaCl2+Ca(ClO)2+2H2O;
(2)①步骤Ⅰ中已获得Br2,步骤Ⅱ中又将Br2还原为Br-,目的是低浓度的Br2溶液在提取时消耗过多的原料和能源,转化为HBr后易被氧化剂氯气氧化为溴单质,用于富集溴元素,二氧化硫吸收溴单质发生反应的化学方程式为SO2+Br2+2H2O=H2SO4+2HBr,故答案为:SO2+Br2+2H2O=H2SO4+2HBr;
②该产物中仍残留的少量Cl2,加入NaBr溶液发生2NaBr+Cl2=2NaCl+Br2,可以除去氯气,生成的溴单质可以用萃取分液的方法分离,故答案为:NaBr;萃取分液.
点评 本题考查海水资源的综合应用,为高频考点,把握粗盐提纯、氧化还原反应、物质的性质为解答的关键,侧重分析与应用能力的考查,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 在氧化还原反应中,甲原子失去的电子比乙原子失去的电子多 | |
| B. | 甲、乙氢氧化物溶液的碱性:甲>乙 | |
| C. | 乙能与盐酸反应放出H2,而甲不能 | |
| D. | 将甲、乙作电极组成原电池时,甲为正极 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解法、热分解法、热还原法 | B. | 热分解法、电解法、热还原法 | ||
| C. | 热还原法、热分解法、热还原法 | D. | 电解法、电解法、热分解法 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | SO32-的空间构型为平面三角形 | |
| B. | SiO2晶体中,最小的环上有6个Si原子和6个O原子 | |
| C. | CuSO4•5H2O中Cu的配位数为4 | |
| D. | SnBr2分子中Sn-Br的键角为120° |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
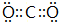 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
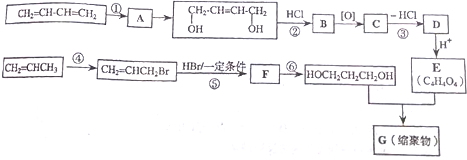
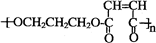 +2nH2O
+2nH2O查看答案和解析>>
科目:高中化学 来源: 题型:选择题
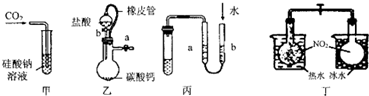
| A. | 甲装置:可用来证明碳的非金属性比硅强 | |
| B. | 乙装置:橡皮管的作用是保证装置不漏气 | |
| C. | 丙装置:用图示的方法检查此装置的气密性 | |
| D. | 丁装置:探究温度对平衡的影响 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 工业上常用电解熔融D的氧化物来制备D的单质 | |
| B. | 单质C、D着火,灭火时C不能用泡沫灭火器,但D可以用泡沫灭火器灭火 | |
| C. | 化合物A2B2与C2B2所含化学键类型完全相同 | |
| D. | A、B、C组成的化合物,若溶液浓度为0.01mol/L,则由水电离出的OH-为10-12mol/L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com