
| A. | 混合前醋酸溶液中水的电离程度大 | |
| B. | 混合前c(CH3COOH)大于c(Na+) | |
| C. | 混合后若c(Na+)=c(CH3COO-),则混合前乙酸体积大 | |
| D. | 分别稀释10倍,两溶液的pH之和大于14 |
分析 A.酸溶液和碱溶液都抑制了水的电离,盐酸中氢离子与氢氧化钠溶液中氢氧根离子浓度都是0.1mol/L,所以对水的电离的影响相同;
B.醋酸为弱酸,醋酸的浓度远远大于0.1mol/L,氢氧化钠为强电解质,则氢氧化钠的浓度为0.1mol/L;
C.混合后若c(Na+)=c(CH3COO-),溶液为中性,则c(H+)=c(OH-),pH=1的醋酸溶液和pH=13的NaOH溶液混合醋酸有电离出氢离子;
D.pH=13的氢氧化钠溶液稀释10倍后,溶液的pH=12,醋酸为弱酸,稀释后溶液的pH<2.
解答 解:A.常温下pH=1的醋酸溶液中氢离子浓度为0.1mol/L,pH=13的NaOH溶液中氢氧根离子浓度为0.1mol/L,两溶液都抑制了水的电离,所以两溶液中水的电离程度相等,故A错误;
B.醋酸溶液中氢离子浓度为0.1mol/L,醋酸为弱酸,则醋酸的浓度远远大于0.1mol/L,即c(CH3COOH)>0.1mol/L,而pH=13的NaOH溶液中c(Na+)浓度为0.1mol/L,所以醋酸溶液中c(CH3COOH)大于NaOH溶液中c(Na+),故B正确;
C.混合后若c(Na+)=c(CH3COO-),溶液pH=7,则c(H+)=c(OH-),pH=1的醋酸溶液和pH=13的NaOH溶液混合,醋酸又电离出氢离子,所以混合后溶液pH=7,需要氢氧化钠溶液体积大,故C错误;
D.氢氧化钠为强电解质,pH=13的氢氧化钠溶液稀释10倍后,溶液的pH=12,醋酸为弱酸,稀释过程中醋酸的电离程度增大,则稀释后醋酸溶液的pH<2,所以稀释后两溶液的pH之和小于14,故D错误;
故选B.
点评 本题考查了离子浓度大小比较、酸碱混合的定性判断,题目难度中等,注意掌握酸碱混合的定性判断方法,明确电荷守恒、物料守恒及盐的水解原理在判断离子浓度大小中的应用.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:推断题
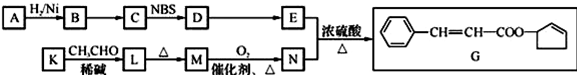
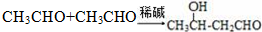
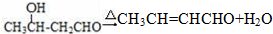
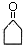 .
. .
.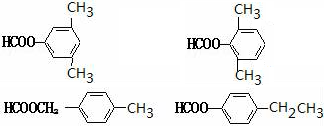 任意2种.
任意2种.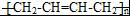 ).请设计合成路线(其他无机原料任选)并用如下方式表示:A$→_{反应条件}^{反应试剂}$B$→_{反应条件}^{反应试剂}$…目标产物HOCH2CH2CH2CH3$→_{△}^{浓硫酸}$CH2=CHCH2CH3$\stackrel{NBS}{→}$CH2=CHCHBrCH3$→_{△}^{NaOH醇溶液}$CH2=CHCH=CH2$\stackrel{催化剂}{→}$
).请设计合成路线(其他无机原料任选)并用如下方式表示:A$→_{反应条件}^{反应试剂}$B$→_{反应条件}^{反应试剂}$…目标产物HOCH2CH2CH2CH3$→_{△}^{浓硫酸}$CH2=CHCH2CH3$\stackrel{NBS}{→}$CH2=CHCHBrCH3$→_{△}^{NaOH醇溶液}$CH2=CHCH=CH2$\stackrel{催化剂}{→}$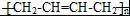 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | W、X、Y、Z原子的核外最外层电子数的总和为22 | |
| B. | 上述四种元素的原子半径大小为W<X<Y<Z | |
| C. | 有W与X组成的化合物的沸点总低于由W与Y组成的化合物的沸点 | |
| D. | W与Y可形成既含极性共价键又含非极性共价键的化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
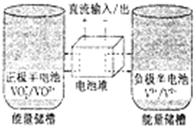 全钒氧化还原电池是一种新型可充电池,不同价态的含钒离子作为正极和负极的活性物质,分别储存在各自的酸性电解液储罐中.其结构原理如图所示,该电池放电时,右槽中的电极反应为:V2+-e-═V3+,下列说法正确的是( )
全钒氧化还原电池是一种新型可充电池,不同价态的含钒离子作为正极和负极的活性物质,分别储存在各自的酸性电解液储罐中.其结构原理如图所示,该电池放电时,右槽中的电极反应为:V2+-e-═V3+,下列说法正确的是( )| A. | 放电时,右槽发生还原反应 | |
| B. | 放电时,左槽的电极反应式:VO2++2H++e-═VO2++H2O | |
| C. | 充电时,每转移1mol电子,n(H+)的变化量为1mol | |
| D. | 充电时,阴极电解液pH升高 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | HNO3 | B. | HCl | C. | HBr | D. | HF |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | $\frac{53}{84}$<a<$\frac{53}{62}$ | |
| B. | a=$\frac{53}{65}$时,m2中固体为Na2CO3和NaOH | |
| C. | a=$\frac{53}{75}$时,m2中固体为Na2CO3 | |
| D. | 若m1=58.4,m2=56.6,则m1中NaHCO3为0.1mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaAlO2和KOH | B. | NaHCO3和Ca(OH)2 | C. | AlCl3和氨水 | D. | HCl和Na2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H3PO4 | B. | Na3PO4 | C. | Ag | D. | Na2HPO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com