
【题目】将0.1 mol的镁、铝混合物溶于100 mL 2mol/L H2SO4溶液中,然后再滴加1 mol/L NaOH溶液。请回答:
(1)若在滴加NaOH溶液的过程中,沉淀质量m随加入NaOH溶液的体积V变化如下图所示。

当V1=160mL时,则金属粉末中n(Mg)=________ mol,V2=_____________mL。
(2)若在滴加NaOH溶液过程中,欲使Mg2+、Al3+刚好沉淀完全,则滴入NaOH溶液的体积V(NaOH) _____________mL。
(3)若混合物仍为0.1 mol,其中Mg粉的物质的量分数为a,用100 mL 2 mol/L的硫酸溶解此混合物后,再加入450 mL 1mol/L的NaOH溶液,所得沉淀中无Al(OH)3。满足此条件的a的取值范围是:_____________。
【答案】 Mg为0.06mol V2 = 400+40=440 ml 400ml Al的最大值是剩余的氢氧化钠全用于溶解Al(OH)3 ,即为0.05mol,则Al的最大值为0.05mol,此时a=0.5,为最小值,a的最大值是合金中无Al,即a=1,所以 0.5 ≤a<1
【解析】(1)当时V1=160mL,此时溶液是MgSO4、Al2(SO4)3和Na2SO4混合液,由Na+离子守恒可知,n(Na2SO4)= ![]() n(Na+)=
n(Na+)=![]() n(NaOH)=
n(NaOH)= ![]() ,设MgSO4为xmol、Al2(SO4)3为ymol,则:根据原子Mg、Al原子守恒有:x+2y=0.1,100mL 2mol/L的H2SO4溶液中含有硫酸的物质的量为:2mol/L×0.1L=0.2mol,根据SO42-离子守恒有:x+3y=0.2-0.08=0.12,联立方程解得:x=0.06、y=0.02,所以金属粉末中:n(Mg)=0.06mol,n(Al)=2y=2×0.02mol=0.04mol;滴加NaOH溶液到体积V2时,溶液是Na2SO4和NaAlO2混合液,根据SO42-离子、Na+离子和Al原子守恒有:n(NaOH)=2n(Na2SO4)+n(NaAlO2)=2n(H2SO4)+n(Al)=2×0.2mol+0.04mol=0.44mol,则V2点消耗NaOH溶液的体积为
,设MgSO4为xmol、Al2(SO4)3为ymol,则:根据原子Mg、Al原子守恒有:x+2y=0.1,100mL 2mol/L的H2SO4溶液中含有硫酸的物质的量为:2mol/L×0.1L=0.2mol,根据SO42-离子守恒有:x+3y=0.2-0.08=0.12,联立方程解得:x=0.06、y=0.02,所以金属粉末中:n(Mg)=0.06mol,n(Al)=2y=2×0.02mol=0.04mol;滴加NaOH溶液到体积V2时,溶液是Na2SO4和NaAlO2混合液,根据SO42-离子、Na+离子和Al原子守恒有:n(NaOH)=2n(Na2SO4)+n(NaAlO2)=2n(H2SO4)+n(Al)=2×0.2mol+0.04mol=0.44mol,则V2点消耗NaOH溶液的体积为![]() ;
;
(2)使Mg2+、Al3+刚好完全沉淀,此时溶质为硫酸钠,则n(NaOH)=2n(Na2SO4) =0.4mol,加入的NaOH的体积为:V=![]() ;
;
(3) 若混合物仍为0.1 mol,其中Mg粉的物质的量分数为a,用100mL 2mol/L的硫酸溶解此混合物后,再加入450mL 1mol/L的NaOH溶液,所得沉淀中无Al(OH)3,证明生成的Al(OH)3全部和NaOH反应,由上述分析知Mg2+、Al3+恰好完全沉淀时消耗400mL NaOH溶液,再加入50mL 1mol/L NaOH溶液,所得Al(OH)3沉淀完全溶于NaOH生成NaAlO2,Al(OH)3+NaOH= NaAlO2+ 2H2O,Al(OH)3最大取值0.05mol,即0< n(Al)≤.05mol,n(Mg)+n(Al)=0.1mol,则0.5≤.n(Mg)<1,则0.5≤a<1。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】下列物质与功能对应的是( )
A. 核糖核酸:细胞内储存遗传信息 B. 淀粉:动物细胞内的储能物质
C. 胰岛素受体:向细胞内传递信息 D. 植物蜡:植物细胞的储能物质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溶液 A中可能含有如下离子:Na+、NH4+、Ba2+、Mg2+、SO42-、SO32-、Cl-、OH-。某同学设计并完成了如下的实验:
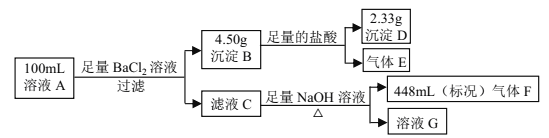
下列说法正确的是
A. 溶液 A 中一定存在 NH4+、 SO42-、 SO32-,可能存在 Na+
B. 溶液 A 中一定存在 NH4+、 Mg2+、 SO42-、 SO32-,可能存在 Cl-
C. 溶液 A 中可能存在 Cl-,且 c(Na+) ≥ 0.20 mol·L-1
D. 如果气体 F 能使湿润的蓝色石蕊试纸变红,说明溶液中一定含有 NH4+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒容密闭容器中进行反应:X2(g)+3Y2(g) ![]() 2Z2(g),若X2、Y2、Z2的初始浓度分别为0.1 mol·L-1、0.3 mol·L-1、0.2 mol·L-1,当反应达到平衡后,各物质的浓度有可能是
2Z2(g),若X2、Y2、Z2的初始浓度分别为0.1 mol·L-1、0.3 mol·L-1、0.2 mol·L-1,当反应达到平衡后,各物质的浓度有可能是
A.X2为0.2 mol·L-1 B.Y2为0.1 mol·L-1
C.Z2为0.4mol·L-1 D.Y2为0.6 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关细胞中的元素和化合物的叙述,正确的是( )
A. 构成细胞的最基本元素是碳,这与其含量最高有关
B. 脂肪分子中氢的含量比糖类高,是细胞主要的能源物质
C. 细胞中的RNA分子一般是单链,且不含氢键
D. 细胞中的一个环状n肽分子被彻底水解需要破坏n个肽键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于细胞中元素和化合物的描述,正确的是( )
A. C是活细胞中含量最多的元素,是生命的核心元素
B. 蛋白质是活细胞中含量最多的有机物,是生命活动的重要物质
C. RNA分子携带大量的遗传信息,是主要的遗传物质
D. 糖原分子中贮存大量能量,是生命活动的直接能源物质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤的气化是对煤进行深加工的重要方法,其主要反应是碳和水蒸气反应生成水煤气。
(1)已知在101KPa、150℃时,各1mol的碳、一氧化碳和氢气在足量的氧气充分燃烧并恢复至原温度,所放出的热量分别为393.7kJ/mol、283.0kJ/mol、242.0 kJ/mol,请写出煤的气化反应的热化学方程式__________________;请从热力学角度简述该反应在某条件下能够正向进行的原因是_______________。
(2)在恒容密闭容器里,按物质的量比1:1加入一定量的碳和水蒸气反应生成水煤气。一定条件下达到平衡,当改变反应的某一条件时,下列变化能说明平衡一定向正反应方向移动的是_________。(填序号)
A.正反应速率先增大后减少 B.化学平衡常数K减少
C.混合气体的平均相对分子质量减少 D.反应物气体体积分数增大
(3)一定条件下煤的气化产物还可以发生反应,700℃时,向容积为2L的密闭容器中充入一定量的CO和H2O,发生反应:CO(g)+H2O(g)![]() CO2(g)+ H2(g) 反应过程中测定的部分数据见下表:
CO2(g)+ H2(g) 反应过程中测定的部分数据见下表:
反应时间/ min | n(CO)/ mol | n(H2O)/ mol |
0 | 1.20 | 0.60 |
5 | 0.80 | |
10 | 0.20 |
请根据表格回答下列问题:
①计算反应在5min内由氢气表示的平均速率为:_____________。
②列式并计算该反应在700℃时的化学平衡常数K=__________,如果温度升至800℃,上述反应平衡常数为0.64,则正反应为___________(填“吸热”或“放热”)反应。
③将上表中达平衡后的混合气体恢复至室温,用200mL2mol/LNaOH溶液进行吸收,充分反应后假设溶液体积不变,下列说法不正确的是:(已知HCO3-电离常数约为4![]() 10-11,CaCO3的溶度积常数约为3
10-11,CaCO3的溶度积常数约为3![]() 10-9)___________
10-9)___________
A.c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-)
B.c(H2CO3)<c(CO32-)
C.c(Na+)+c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3)
D.向该溶液中加入等体积等浓度的CaCl2溶液产生白色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙炔为原料制取CHClBr—CH2Br,下列方法最可取的是( )
A.先与HBr加成后再与HCl加成
B.先与HCl加成后再与Br2加成
C.先与H2完全加成后再与Cl2、Br2取代
D.先与Cl2加成后再与HBr加成
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com