
单质Z是一种常见的半导体材料,可由X通过如下图所示的路线制备,其中X为Z的氧化物.Y为氢化物,分子结构与甲烷相似,回答下列问题;
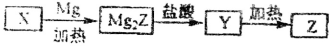
(1)能与X发生化学反应的酸是_______(写名称);由X制备Mg2Z的化学方程式为___ __。
(2)由Mg2Z生成Y的化学反应方程式为___________________,Y分子的电子式为________________
(3)Z、X中化学键的类型都是_________________。
 出彩同步大试卷系列答案
出彩同步大试卷系列答案科目:高中化学 来源:2015-2016学年山东枣庄三中高二10月学情调查化学卷(解析版) 题型:选择题
如图所示,装置中都盛有0.1mol·L-1 的NaCl 溶液,放置一定时间后,装置中的四块相同的锌片腐蚀速率由快到慢的正确顺序是:( )
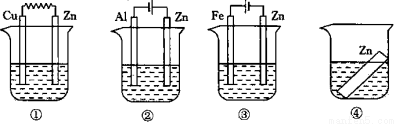
A.①②③④ B.①②④③ C.②①④③ D.③①④②
查看答案和解析>>
科目:高中化学 来源:2015-2016学年广东省高二上期中测试化学试卷(解析版) 题型:实验题
实验室需要配制0.50 mol/L NaCl溶液480 mL,现使用NaCl固体配制,按下列操作步骤填上适当的文字,以使整个操作完整。
Ⅰ.(1)选择仪器。完成本实验所必需的仪器有:托盘天平(精确到0.1 g)、药匙、烧杯、玻璃棒、__________、_________________以及等质量的两片滤纸。
(2)计算。配制该溶液需取NaCl晶体________ g。
(3)称量。
①天平调平。 ②称量。 ③称量完毕,将药品倒入烧杯中。
(4)溶解、冷却,该步实验中需要使用玻璃棒,目的是___________________。
(5)转移、洗涤。在转移时应使用________引流,需要洗涤烧杯2~3次是为了_______________________。
(6)定容、摇匀。
(7)将配好的溶液静置一段时间后,倒入指定的试剂瓶中,并贴好标签,注明配制的时间、溶液名称及浓度。
(8)在配制过程中,某学生观察定容时液面情况如图所示,所配溶液的浓度会______(填“偏高”、“偏低”或“无影响”)。
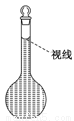
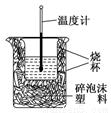
Ⅱ.实验室利用如图装置进行中和热的测定,请回答下列问题:
(1)该图中有两处未画出,它们是________________,________________。
(2)在操作正确的前提下,提高中和热测定准确性的关键是_________________。
(3)如用0.5 mol/L的盐酸与NaOH固体进行实验,则实验中测得的“中和热”数值将________(填“偏大”、“偏小”、“不变”);原因是_______________。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年吉林实验中学高一上学期期中考试化学试卷(解析版) 题型:选择题
容量瓶上需标有:①温度 ②浓度 ③容量  ④压强 ⑤刻度线 ⑥酸式或碱式;六项中的
④压强 ⑤刻度线 ⑥酸式或碱式;六项中的
A.①③⑤ B.③⑤⑥ C.①②④ D.②④⑥
查看答案和解析>>
科目:高中化学 来源:2016届浙江嘉兴第一中学高三上学期能力测试理综化学试卷(解析版) 题型:填空题
烟气脱硫(SO2)脱硝(NOx)一体化技术是大气污染防治研究的热点。烟气中NO通常占NOx总量的90%以上,但NO的脱除难度较大。某研究小组探究用次氯酸钙溶液同时脱除烟气中SO2和NO的方法。
脱硫:Ca(ClO)2(aq) + 2SO2(g) + 2H2O(l)=CaSO4(s) + H2SO4(aq) + 2HCl(aq) Ⅰ
脱硝:3Ca(ClO)2(aq) + 4NO(g) + 2H2O(l)=3CaCl2(aq) + 4HNO3(aq) Ⅱ
请回答:
(1)脱硫过程涉及的各化学反应及其ΔH如下:
SO2(g) + H2O(l)  H2SO3(aq) ΔH=a
H2SO3(aq) ΔH=a
Ca(ClO)2(aq) + H2SO3(aq) = CaSO3(s) + 2HClO(aq) ΔH=b
CaSO3(s) + HClO(aq) = CaSO4(s) + HCl(aq) ΔH=c
H2SO3(aq) + HClO(aq) = H2SO4(aq) + HCl(aq) ΔH=d
脱硫反应Ⅰ的ΔH1= 。
(2)脱硫反应Ⅰ和脱硝反应Ⅱ的平衡常数随温度的变化如下图所示: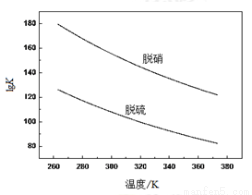
①判断反应Ⅱ的ΔS2 0、ΔH2 0(填<、=或>),指出有利于自发进行的温度条件是 (填“较高温度”或“较低温度”)。
②预测用次氯酸钙溶液脱硫脱硝反应进行的程度并说明理由 。
(3)与NaClO溶液吸收法相比,Ca(ClO)2法更能促进脱硫反应进行,理由是 。
(4)与NaOH溶液吸收法相比,Ca(ClO)2法的脱硫脱硝效率更高,理由是 。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年安徽省高二上学期期中测试化学试卷(解析版) 题型:填空题
在一定温度下将3 mol CO2和2 mol H2混合于2 L的密闭容器中,如下反应:CO2(g)+H2(g)  CO(g)+H2O(g)
CO(g)+H2O(g)
(1)该反应的化学平衡常数表达式K=________。
(2)已知在700 ℃时,该反应的平衡常数K1=0.6,则该温度下反应CO(g)+H2O(g)  CO2(g)+H2(g)的平衡常数K2=________,反应
CO2(g)+H2(g)的平衡常数K2=________,反应 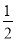 CO2(g)+
CO2(g)+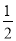 H2(g)
H2(g) 
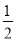 CO(g)+
CO(g)+ H2O(g)的平衡常数K3=________。
H2O(g)的平衡常数K3=________。
(3)已知在1 000 ℃时,该反应的平衡常数K4为1.0,则该反应为________反应(填“吸热”或“放热”)。
(4)能判断该反应达到化学平衡状态的依据是______。(填编号)
A.容器中压强不变
B.c(CO2)=c(CO)
C.生成a mol CO2的同时消耗a mol H2
D.混合气体的平均相对分子质量不变
(5)在1 000 ℃下,某时刻CO2的物质的量为2.0 mol,则此时v正________v逆(填“>”、“=”或“<”)。该温度下反应达到平衡时,CO2的转化率为________。
查看答案和解析>>
科目:高中化学 来源:2016届山东省高三12月月考化学试卷(解析版) 题型:选择题
氯酸是一种强酸,浓度超过40%时会发生分解,反应可表示为:a HClO3 = bO2↑+ c Cl2↑+ d HClO4 + e H2O。用湿润的淀粉碘化钾试纸检验气体时,试纸先变蓝后褪色。下列有关说法正确的是( )
A.由反应可确定:氧化性HClO4 >HClO3
B.该反应的还原产物是O2和HClO4
C、试纸先变蓝后褪色是因为Cl2具漂白性
D.若化学计量数a=8,b=3,则该反应转移电子数为20e-
查看答案和解析>>
科目:高中化学 来源:2015-2016学年福建省高二上学期期中测试化学试卷(解析版) 题型:选择题
下列说法正确的是
A.增大压强,活化分子百分数增多,化学反应速率一定增大
B.升高温度,活化分子百分数不变,化学反应速率一定增大
C.加入反应物,使活化分子百分数增大,化学反应速率增大
D.使用催化剂,降低了反应的活化能,增大了活化分子百分数,化学反应速率一定增大
查看答案和解析>>
科目:高中化学 来源:2016届江苏省淮安市高三上学期10月阶段测化学试卷(解析版) 题型:选择题
下列图示与对应的叙述相符的是
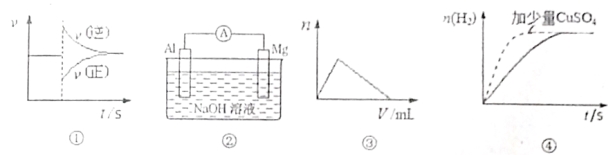
A、图①可以表示对某化学平衡体系改变温度后反应速率的变化
B、图②中由于Mg比Al活泼,所以Mg为负极
C、图③可以表示向明矾溶液中滴加氢氧化钠溶液产生沉淀量的变化
D、图④可以表示足量锌粉与稀硫酸反应,加少量CuSO4固体产生H2的变化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com