
化学键的键能是原子间形成1 mol化学键(或其逆过程)时释放(或吸收)的能量。以下是部分共价键键能的数据:
H—S:364 kJ·mol-1,S—S:266 kJ·mol-1,S===O:522 kJ·mol-1,
H—O:464 kJ·mol-1。
(1)试根据这些数据计算下面这个反应的反应热:
2H2S(g)+SO2(g)=3S(s)+2H2O(l) ΔH=-Q kJ·mol-1,反应产物中的S实为S8,实际分子是8元环状分子( 提示:由8molS形成8mol S—S可推知平均1molS含有的S—S,然后计算),则Q=_________。
提示:由8molS形成8mol S—S可推知平均1molS含有的S—S,然后计算),则Q=_________。
(2)标准状况下,将a L H2S与b L SO2混合进行上述反应,当a>2b时,反应放热____________kJ·mol-1;当a<2b时,反应放热____________kJ·mol-1。
(3)又已知H2O(l)=H2O(g) ΔH=+44 kJ·mol-1请写出(1)中反应若生成气态水时的热化学方程式 。
科目:高中化学 来源: 题型:
| 键能 | 键能 | 键能 | |||
| H-H | 436 | Cl-Cl | 243 | C-F | 427 |
| H-N | 393 | H-O | ? | H-F | 565 |
| C-Cl | 330 | H-S | 339 | H-Cl | 431 |
| C-O | 347 | C-I | 218 | H-Br | 366 |
查看答案和解析>>
科目:高中化学 来源: 题型:
化学键的键能是原子间形成1mol化学键(或其逆过程)时释放(或吸收)的能量。以下是部分共价键键能的数据:
H—S:364 kJ·mol-1,S—S:266 kJ·mol-1,S===O:522 kJ·mol-1,
H—O:464 kJ·mol-1。
(1)试根据这些数据计算下面这个反应的反应热:
2H2S(g)+SO2(g)=3S(s)+2H2O(l) ΔH=-Q kJ·mol-1,反应产物中的S实为S8,实际分子是8元环状分子(提示:由8molS形成8mol S—S可推知平均1molS含有的S—S,然后计算),则Q=_________。
(2)标准状况下,将a L H2S与b L SO2混合进行上述反应,当a>2b时,反应放热____________kJ·mol-1;当a<2b时,反应放热____________kJ·mol-1。
(3)又已知H2O(l)=H2O(g) ΔH=+44 kJ·mol-1请写出(1)中反应若生成气态水时的热化学方程式 。
查看答案和解析>>
科目:高中化学 来源:2013届度陕西省上学期高二期末考试化学试卷 题型:填空题
化学键的键能是原子间形成1 mol化学键(或其逆过程)时释放(或吸收)的能量。以下是部分共价键键能的数据:
H—S:364 kJ·mol-1,S—S:266 kJ·mol-1,S===O:522 kJ·mol-1,
H—O:464 kJ·mol-1。
(1)试根据这些数据计算下面这个反应的反应热:
2H2S(g)+SO2(g)=3S(s)+2H2O(l) ΔH=-Q kJ·mol-1,反应产物中的S实为S8,实际分子是8元环状分子(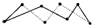 提示:由8molS形成8mol S—S可推知平均1molS含有的S—S,然后计算),则Q=_________。
提示:由8molS形成8mol S—S可推知平均1molS含有的S—S,然后计算),则Q=_________。
(2)标准状况下,将a L H2S与b L SO2混合进行上述反应,当a>2b时,反应放热____________kJ·mol-1;当a<2b时,反应放热____________kJ·mol-1。
(3)又已知H2O(l)=H2O(g) ΔH=+44 kJ·mol-1请写出(1)中反应若生成气态水时的热化学方程式 。
查看答案和解析>>
科目:高中化学 来源:同步题 题型:填空题
 ),则Q=____________。
),则Q=____________。 查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com