
【题目】硒化锌是一种透明黄色半导体,也可作红外光学材料,熔点1520℃。
(1)锌离子的电子排布式是_____________。
(2)根据元素周期律,电负性S______Se,第一电离能Se________As(填“>”或“<”)。
(3)H2O的沸点______________(填“>”或“<”)H2Se的沸点,其原因是:______。
(4)铜晶体中铜原子的堆积方式如图所示,铜晶体中原子的堆积模型属于______。若已知铜的原子半径为d厘米,表示原子空间占有率的代数式为_____________

(5)A是短周期中原子半径最大的元素; C是A所在周期电负性最大的元素;A、C两元素形成的化合物组成的晶体中,阴、阳离子都具有球型对称结构,它们都可以看做刚性圆球,并彼此“相切”。如下图所示为A、C形成化合物的晶胞结构图。
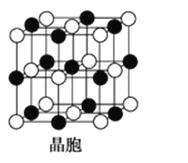
晶胞中距离一个A+最近的C-围成的图形是______________(写名称),若晶体密度为ρ g·cm-3,阿伏加德罗常数的值用NA表示,晶体中距离最近的两个A+之间的距离为________cm(用含NA与ρ的式子表达)。
【答案】 1s22s22p63s23p63d10或[Ar]3d10 > < > H2O分子间存在氢键 面心立方堆积 ![]() 正八面体
正八面体 ![]()
【解析】(1)Zn是30号元素,其原子核外有30个电子,其3d、4s电子为其价电子,其价电子排布式为![]() ,正确答案:
,正确答案:![]() 。
。
(2)同一主族元素,元素电负性随着原子序数增大而减小,所以电负性![]() ;同一周期元素第一电离能随着原子序数增大而呈增大趋势,但第IIA族、第VA族元素第一电离能大于其相邻元素,所以第一电离能
;同一周期元素第一电离能随着原子序数增大而呈增大趋势,但第IIA族、第VA族元素第一电离能大于其相邻元素,所以第一电离能![]() ;正确答案:> ; <。
;正确答案:> ; <。
(3)含有氢键的氢化物熔沸点较高,![]() 含有氢键、
含有氢键、![]() 不含氢键,导致
不含氢键,导致![]() 的沸点(100℃)高于
的沸点(100℃)高于![]() 的沸点
的沸点![]() ℃);正确答案:> ; H2O分子间存在氢键。
℃);正确答案:> ; H2O分子间存在氢键。
(4)由铜晶体中铜原子的堆积方式图可以知道,铜晶体中原子的堆积模型属于面心立方密堆积;根据图片知,铜单质为面心立方最密堆积,铜原子配位数![]() ,铜的原子半径为d厘米,晶胞的边长为
,铜的原子半径为d厘米,晶胞的边长为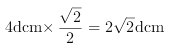 ,每个铜晶胞中含有4个原子,则铜原子总体积为
,每个铜晶胞中含有4个原子,则铜原子总体积为![]() ,晶胞体积为
,晶胞体积为![]() ,故空间利用率为
,故空间利用率为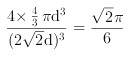 ;正确答案:面心立方堆积 ;
;正确答案:面心立方堆积 ;![]() 。
。
(5)A是短周期中原子半径最大的元素,A 为钠元素;C是A所在周期电负性最大的元素,C为氯元素;由Na、Cl两元素形成的化合物为NaCl,以中间的黑色球为Na+离子研究,与之最近的氯离子有6个,这些氯离子围成的图形是正八面体;晶胞中Na+离子数目=1+12×![]() =4,Cl-离子数目=8×
=4,Cl-离子数目=8×![]() +6×
+6×![]() =4,故晶胞质量=
=4,故晶胞质量=![]() g,晶胞体积=[
g,晶胞体积=[![]() g÷ρ]cm3=
g÷ρ]cm3=![]() cm3,设晶胞棱长为r cm,则 r=
cm3,设晶胞棱长为r cm,则 r= ![]() ,晶体中距离最近的两个Na+之间的距离为
,晶体中距离最近的两个Na+之间的距离为![]() r=
r= ![]() ;正确答案:
;正确答案: ![]() 。
。


 计算高手系列答案
计算高手系列答案科目:高中化学 来源: 题型:
【题目】下列说法中错误的是 ( )
A. 元素电负性越大的原子,吸引电子的能力越强
B. 在![]() 和
和![]() 中都存在配位键
中都存在配位键
C. SO2、SO3都是极性分子
D. 原子晶体中原子以共价键结合,具有键能大、熔点高、硬度大的特性
查看答案和解析>>
科目:高中化学 来源: 题型:
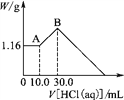
【题目】将NaOH、MgCl2、AlCl3三种固体组成的混合物溶于足量水后,产生1.16 g白色沉淀,再向所得浊液中逐渐加入1.00 mol/L HCl溶液,加入HCl溶液的体积与生成沉淀的关系如下图所示。
试回答:
(1)A点的沉淀的化学式为________,理由是_______________________________________;
(2)写出A点至B点发生反应的离子方程式: _____________________________________;
(3)原混合物中AlCl3的质量是________g,NaOH的物质的量是________ mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以 NA表示阿伏加德罗常数的值,下列说法正确的是( )
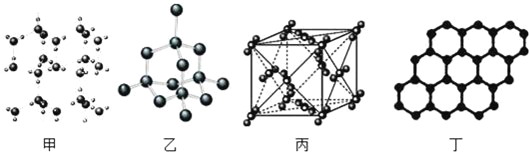
A. 18g 冰(图甲)中含 O﹣H 键数目为 4NA
B. 28g 晶体硅(图乙)中含有σ键数目为 4NA
C. 44g 干冰(图丙)中含有 0.25NA个晶胞结构单元
D. 石墨烯(图丁)是碳原子单层片状新材料,12g 石墨烯中含π键数目为 1.5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有下列8种晶体,用序号回答下列问题:
A.水晶 B.白磷 C.冰醋酸 D.固态氩 E.氯化铵 F.铝 G.金刚石
(1)含有非极性键的原子晶体是_________ ,属于原子晶体的化合物是_______,不含化学键的分子晶体是 _______,属于分子晶体的单质是_________
(2)含有离子键、共价键、配位键的化合物是___________,受热熔化,需克服共价键的是___________.
(3)金刚砂(SiC)的结构与金刚石相似,硬度与金刚石相当,则金刚砂的晶胞中含有_____个硅原子,______个碳原子;金刚石熔点高于金刚砂的原因_____________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列8种有机物:①CH2=CH2;②![]() ;③
;③![]() ;④CH3CH2Cl;⑤CCl4;⑥CH≡CH;⑦
;④CH3CH2Cl;⑤CCl4;⑥CH≡CH;⑦![]() ;⑧CH3CH2OH。根据官能团的不同,有机物可分为( )
;⑧CH3CH2OH。根据官能团的不同,有机物可分为( )
A. 4类 B. 5类 C. 6类 D. 7类
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.次磷酸(H3PO2) 是一种精细磷化工产品,具有较强还原性:
(1)H3PO2是一元中强酸,写出其电离方程式_____________。
(2)H3PO2 及NaH2PO2 均可将溶液中的Ag+还原为银,从而可用于化学镀银。利用H3PO2 进行化学镀银反应中,当氧化产物为H3PO4 时,氧化剂与还原剂的物质的量之比为_____.
Ⅱ.工业上采用硫铁矿焙烧去硫后的烧渣(主要成分为Fe2O3、FeO、SiO2、Al2O3,不考虑其他杂质),制取七水合硫酸亚铁(FeSO4·7H2O),流程如图:

(3)还原时,试剂X 若选用SO2,则反应后的阴离子是__________(填化学式)。
(4)从分离出滤渣Ⅱ后的滤液中得到产品,应进行的操作是_____、______、过滤、洗涤、干燥。
(5)七水合硫酸亚铁(FeSO4·7H2O) 在医学上常用作补血剂。某课外小组通过以下实验方法测定某补血剂中亚铁离子的含量。
步骤a: 取10片补血剂样品除去糖衣、研磨、溶解、过滤,将滤液配成250mL 溶液;
步骤b: 取上述溶液25mL 于锥形瓶中,加入少量稀硫酸酸化后,逐渐滴加0.010mol/L 的KMnO4
溶液,至恰好完全反应,记录消耗的KMnO4 溶液的体积(假定药品中其他成分不与KMnO4 反应),发生的反应为:MnO4-+5Fe2++8H+=5Fe3++Mn2++4H2O;
步骤c: 重复“步骤b”2~3 次,平均消耗KMnO4 溶液20.00mL。
①步骤a 中配制溶液时需要的玻璃仪器除烧杯、胶头滴管外,还需要____、____。
②该补血剂中亚铁离子的含量为__________mg/片。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可用于分离或提纯物质的方法有:过滤、蒸发结晶、蒸馏、萃取、分液、洗气。根据需求填下列装置的序号:
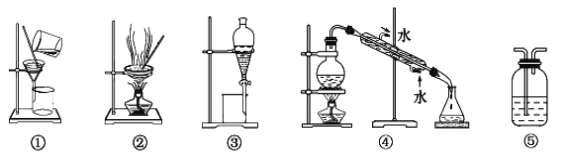
(1)分离Na2CO3溶液和CCl4,选_____(填序号),操作名称为________。
(2)用氢氧化钠溶液吸收O2中混有的杂质Cl2,选_______,操作名称为________。
(3)除去澄清石灰水中悬浮的CaCO3颗粒选______,操作名称为__________。
(4)制取蒸馏水,选________,操作名称为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组中的离子,能在溶液中大量共存的是( )
A.Fe3+、Na+、Cl﹣、OH﹣
B.Fe3+、Cl﹣、K+、Ca2+
C.Cl﹣、Ca2+、Mg2+、CO32﹣
D.Ba2+、K+、CO32﹣、Cl﹣
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com