
分析 (1)反应SiCl4+2H2═Si+4HCl中,Si元素化合价降低,被还原,SiCl4为氧化剂,H元素化合价升高,被氧化,H2为还原剂,结合反应的化学方程式解答该题;
(2)乙酸和碳酸钙反应生成乙酸钙、二氧化碳和水,甲烷燃烧生成二氧化碳和水,对环境无污染,葡萄糖可用于医疗输液补充能量;
(3)氧化铝难溶于水,常温下溴、二氧化氮呈红棕色;过氧化钠能和二氧化碳、水反应生成氧气;二氧化硫具有漂白性,但不稳定.
解答 解:(1)反应中Si元素化合价降低,被还原,SiCl4为氧化剂,H元素化合价升高,被氧化,H2为还原剂,由方程式可知,若反应中生成了1mol Si,则消耗H22mol,转移4mol电子.
故答案为:SiCl4; H2; 2;
(2)乙酸的酸性大于碳酸,乙酸和碳酸钙反应生成乙酸钙、二氧化碳和水,因此可用于清除水壶中水垢(主要成分CaCO3)的是乙酸;甲烷燃烧生成二氧化碳和水,对环境无污染,可做高效清洁能源;葡萄糖可用于医疗输液补充能量;
故答案为:②;①;③;
(3)二氧化硫和水反应生成亚硫酸、二氧化氮和水反应生成硝酸和NO、过氧化钠和水反应生成NaOH和氧气,氧化铝不溶于水,所以难溶于水的是氧化铝;
常温下为红棕色气体的是二氧化氮,能和水反应生成氧气的是过氧化钠,同时生成NaOH;
二氧化硫能和有色物质反应生成无色物质而具有漂白性,且漂白性不稳定,加热易复原,
故选:④;②;③;①.
点评 本题考查氧化还原反应和元素化合物知识,为高考高频考点,侧重于化学与工业生产的考查,有利于培养学生的良好的科学素养,提高学习的积极性,注意从元素化合价的角度解答该题,难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
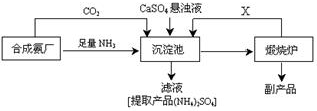
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石灰石与盐酸反应:CO32ˉ+2H+═H2O+CO2↑ | |
| B. | 稀硫酸溶液与氢氧化钡溶液反应:Ba2++SO42-═BaSO4↓ | |
| C. | 铁粉与稀盐酸反应:2Fe+6H+═2Fe3++3H2↑ | |
| D. | 稀硫酸与氢氧化钠溶液反应:H++OHˉ═H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
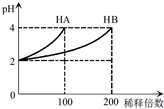 常温下,取pH=2的 HA溶液与HB溶液各1mL,分别加水稀释,测得pH变化与稀释倍数关系如图所示.下列叙述正确的是( )
常温下,取pH=2的 HA溶液与HB溶液各1mL,分别加水稀释,测得pH变化与稀释倍数关系如图所示.下列叙述正确的是( )| A. | HA的电离方程式为HA?H++A- | |
| B. | 稀释前,c(HB)>c(HA)=0.01 mol•L-1 | |
| C. | 0.1mol/L NaB溶液中:c(H+)=c(OH-)+C(HB) | |
| D. | NaA、NaB的混合溶液中:2c(Na+)=c(A-)+c(B-)+c(HB) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苹果汁中的Fe2+变成Fe3+ | B. | 苹果汁中含有Cu2+ | ||
| C. | 苹果汁含有OH- | D. | 苹果汁含有Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com