
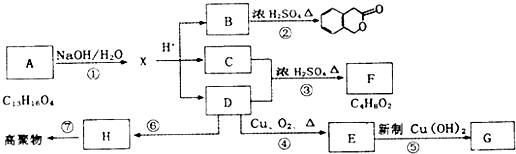
 ④
④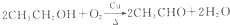 .
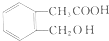
. 分析 H是衡量一个国家石油化工发展水平标志的物质,故H为CH2=CH2,D可以连续发生氧化反应,D属于醇,D转化得到乙烯,应发生醇的消去反应,故D为CH3CH2OH,乙醇发生氧化反应先生成E为CH3CHO,乙醛在新制氢氧化铜碱性溶液中被氧化为乙酸钠,故G为CH3COONa,H发生加聚反应生成高聚物为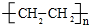 .C与乙醇在浓硫酸作用下生成F,由F的分子式可知,应发生酯化反应,故C为CH3COOH,F为CH3COOCH2CH3.A发生水解再酸化生成乙醇、乙酸和B,A、B属于芳香族化合物,且B不能使FeCl3溶液显紫色,B不含酚羟基,含有羧基、醇羟基,B可以形成六元环化合物,结合A的分子式可知B为
.C与乙醇在浓硫酸作用下生成F,由F的分子式可知,应发生酯化反应,故C为CH3COOH,F为CH3COOCH2CH3.A发生水解再酸化生成乙醇、乙酸和B,A、B属于芳香族化合物,且B不能使FeCl3溶液显紫色,B不含酚羟基,含有羧基、醇羟基,B可以形成六元环化合物,结合A的分子式可知B为 ,以此解答该题.
,以此解答该题.
解答 解:H是衡量一个国家石油化工发展水平标志的物质,故H为CH2=CH2,D可以连续发生氧化反应,D属于醇,D转化得到乙烯,应发生醇的消去反应,故D为CH3CH2OH,乙醇发生氧化反应先生成E为CH3CHO,乙醛在新制氢氧化铜碱性溶液中被氧化为乙酸钠,故G为CH3COONa,H发生加聚反应生成高聚物为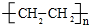 .C与乙醇在浓硫酸作用下生成F,由F的分子式可知,应发生酯化反应,故C为CH3COOH,F为CH3COOCH2CH3.A发生水解再酸化生成乙醇、乙酸和B,A、B属于芳香族化合物,且B不能使FeCl3溶液显紫色,B不含酚羟基,含有羧基、醇羟基,B可以形成六元环化合物,结合A的分子式可知B为
.C与乙醇在浓硫酸作用下生成F,由F的分子式可知,应发生酯化反应,故C为CH3COOH,F为CH3COOCH2CH3.A发生水解再酸化生成乙醇、乙酸和B,A、B属于芳香族化合物,且B不能使FeCl3溶液显紫色,B不含酚羟基,含有羧基、醇羟基,B可以形成六元环化合物,结合A的分子式可知B为 ,
,
(1)根据上面的分析可知,G为CH3COONa,B为 ,
,
故答案为:CH3COONa; ;
;
(2)反应①是酯发生的水解反应,反应⑥是乙醇发生消去反应生成乙烯,
故答案为:水解; 消去;
(3)反应①的化学方程式为 ,反应④的化学方程式为
,反应④的化学方程式为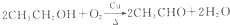 ,
,
故答案为: ;
;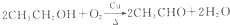 .
.
点评 本题考查有机物推断,为高考常见题型,关键是推断D为乙醇,结合F的分子式确定C为乙酸,再综合分析确定B的结构简式,需要学生熟练掌握官能团的性质与转化,较好地考查学生分析推理能力,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | Na+、Ba2+、Cl-、NO3- | B. | Pb2 +、Hg2 +、S2 -、SO42 - | ||
| C. | NH4+、H+、S2O32-、PO43- | D. | ClO-、Al3 +、Br-、CO32 - |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
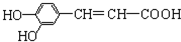 下列有关咖啡酸的说法中,不正确的是( )
下列有关咖啡酸的说法中,不正确的是( )| A. | 1 mol咖啡酸可与3 mol NaOH发生反应 | |
| B. | 咖啡酸可以发生还原、酯化、加聚、显色等反应 | |
| C. | 1 mol咖啡酸可与4 mol Br2发生反应 | |
| D. | 1 mol咖啡酸最多可与5 mol H2发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
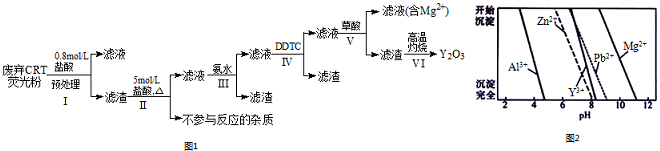
| 阶段/含量%/成分 | Y2O3 | ZnO | Al2O3 | PbO2 | MgO |
| 预处理前 | 24.28 | 41.82 | 7.81 | 1.67 | 0.19 |
| 预处理后 | 68.51 | 5.42 | 4.33 | 5.43 | 0.50 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 软锰矿 | 闪锌矿 |
| MnO2约70%,SiO2约20%,Al2O3约4%,其余为水分 | ZnS约80%,FeS、CuS、SiO2共约7%,其余为水分 |
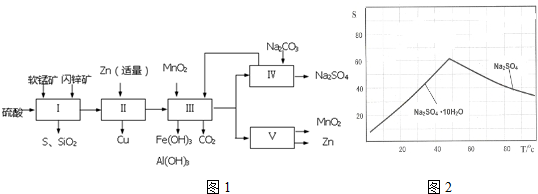
| 氢氧化物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 |
| 开始沉淀pH | 1.5 | 3.3 | 7.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
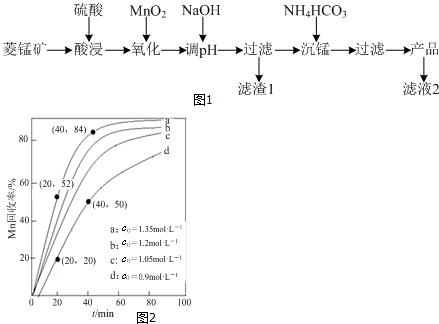
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com