
| A.Pb为正极,PbO2为负极 |
| B.正极电极反应式为PbO2 + SO4 2- + 2H+ =PbSO4 + H2O |
| C.硫酸溶液中,H+移向负极 |
| D.放电一段时间后,SO4 2-浓度减小 |


科目:高中化学 来源:不详 题型:单选题
| A.Ksp(AB2)小于Ksp(CD),则AB2的溶解度小于CD的溶解度 |
| B.在AgCl的沉淀溶解平衡体系中,加入蒸馏水,AgCl的Ksp增大 |
| C.在AgI的沉淀溶解平衡体系中,加入K2S固体,AgI沉淀可转化为Ag2S沉淀 |
| D.在CaCO3的沉淀溶解平衡体系中,通入CO2气体,溶解平衡不移动 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.充电时作阳极,放电时作负极 | B.充电时作阳极,放电时作正极 |
| C.充电时作阴极,放电时作负极 | D.充电时作阴极,放电时作正极 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.镍氢电池、锂电池和碱性锌锰干电池都是二次电池 |
| B.燃料电池是一种高效但是会污染环境的新型电池 |
| C.化学电池的反应基础是氧化还原反应 |
| D.铅蓄电池放电的时候正极材料是Pb,负极材料是PbO2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
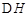 =-2830kJ·mol-1
=-2830kJ·mol-1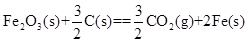
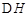 =+230kJ·mol-1
=+230kJ·mol-1
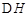 =-390kJ·mol-1
=-390kJ·mol-1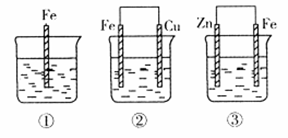
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
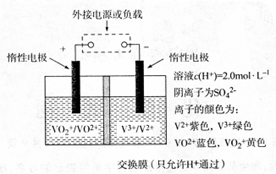
 2H2O ,设计出以稀硫酸为电解质溶液的燃料电池,其电极反应式为:负极 ,正极 。
2H2O ,设计出以稀硫酸为电解质溶液的燃料电池,其电极反应式为:负极 ,正极 。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
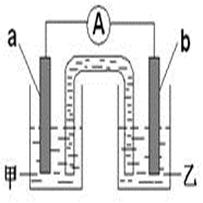
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
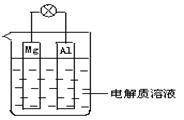
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.电池放电时,正极附近溶液的碱性增强 |
B.电池放电时,负极反应为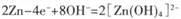 |
C.电池充电时,阳极反应为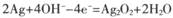 |
| D.充电时锌极与外电源正极相连 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com