
【题目】可以判断油脂皂化反应基本完成的现象是
A.反应液使红色石蕊试纸变蓝B.反应后静置,反应液不分层
C.反应后静置,反应液分为两层D.反应液使蓝色石蕊试纸变红
科目:高中化学 来源: 题型:
【题目】甲醇是重要的化工原料,又可做为燃料.利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:
ⅠCO(g)+2H2(g)CH3OH(g)△H1
ⅡCO2(g)+3H2(g)CH3OH(g)+H2O(g)△H2=﹣58kJ/mol
ⅢCO2(g)+H2(g)CO(g)+H2O(g)△H3
回答下列问题:
(1)物质的标准生成热是常用的化学热力学数据,可以用来计算化学反应热.即化学反应热:△H=生成物标准生成热综合﹣反应物标准生成热总和.
已知四种物质的标准生成热如表:
物质 | CO | CO2 | H2 | CH3OH(g) |
标准生成热(kJ/mol) | ﹣110.52 | ﹣393.51 | 0 | ﹣201.25 |
A.计算△H1=kJ/mol B.△H30(填=、<、>)
(2)由甲醇在一定条件下制备甲醚.一定温度下,在三个体积均为1.0L的恒容密闭容器中发生反应:2CH3OH(g)CH3OCH3(g)+H2O(g).实验数据见表:
容器编号 | 温度(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | |||
CH3OH(g) | CH3OCH3(g) | H2O(g) | CH3OCH3(g) | H2O(g) | ||
a | 387 | 0.20 | 0 | 0 | 0.080 | 0.080 |
b | 387 | 0.40 | 0 | 0 | ||
c | 207 | 0.20 | 0 | 0 | 0.090 | 0.090 |
下列说法正确的是
A.该反应的正反应为放热反应
B.达到平衡时,容器a中的CH3OH体积分数比容器b中的小
C.容器a中反应到达平衡所需时间比容器c中的长
D.若起始时向容器a中充入CH3OH 0.15mol、CH3OCH3 0.15mol和H2O 0.10mol,则反应将向正反应方向进行
(3)合成气的组成 ![]() =2.60时,体系中的CO平衡转化率(α)与温度和压强的关系如图所示.
=2.60时,体系中的CO平衡转化率(α)与温度和压强的关系如图所示.
①α(CO)值随温度升高而(填“增大”或“减小”),其原因是 .
②图中P1、P2、P3的大小关系为 , 其判断理由是 .
(4)甲醇可以制成燃料电池,与合成气制成燃料电池相比优点是:;若以硫酸作为电解质其负极反应为: . 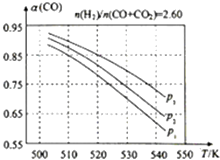
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组学生用50 mL 0.50 mol/L的盐酸与50 mL 0.55 mol/L的NaOH溶液在如下图所示的装置中进行中和反应。通过测定反应过程中所放出的热量计算反应热。下列说法正确的是( )
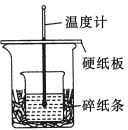
A.如图条件下实验过程中没有热量损失
B.图中实验装置缺少环形玻璃搅拌棒
C.烧杯间填碎纸条的主要作用是固定小烧杯
D.若改用60 mL 0.50 mol/L盐酸跟50 mL 0.55 mol/L的NaOH溶液进行反应,从理论上说所求放出热量相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,下列有关溶液中粒子的物质的量浓度关系正确的是( )
A.0.1mol/LCH3COONa与0.1mol/LHCl溶液等体积混合:c(Na+)=c(Cl﹣)>c(OH﹣)>cCH3COO﹣)
B.0.1mol/LNH4Cl与0.1mol/L氨水等体积混合(pH>7):c(NH3?H2O)>c(NH4+)>c(Cl﹣)>c(OH﹣)
C.0.1mol/LNa2CO3与0.1mol/L NaHCO3溶液等体积混合: ![]() c(Na+)=c(CO32﹣)+c(HCO3﹣)+c(H2CO3)
c(Na+)=c(CO32﹣)+c(HCO3﹣)+c(H2CO3)
D.0.1mol/LNa2C2O4与0.1mol/LHCl溶液等体积混合(H2C2O4为二元弱酸):2c(C2O42﹣)+c(HC2O4﹣)+c(OH﹣)=c(Na+)+c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,Fe(OH)3(s)、Cu(OH)2(s)分别在溶液中达到沉淀溶解平衡后,改变溶液pH,金属阳离子浓度的变化如图所示.据图分析,下列判断错误的是( ) 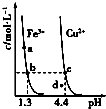
A.Ksp[Fe(OH)3]<Ksp[Cu(OH)2]
B.Fe(OH)3、Cu(OH)2分别在b、c两点代表的溶液中达到饱和
C.加适量NH4Cl固体可使溶液由a点变到b点
D.c、d两点代表的溶液中c(H+)与c(OH﹣)乘积相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】列式并计算下列各小题:
(1)某温度时,测得0.01 mol/L的NaOH溶液pH为11,求该温度下水的离子积常数Kw .
(2)在此温度下,将pH=a的NaOH溶液Va L与pH=b的硫酸Vb L混合.
①若所得混合溶液为中性,且a=12,b=2,则 Va:Vb=
②若所得混合溶液的pH=10,且a=12,b=2,则 Va:Vb= .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用50mL0.50molL﹣1盐酸与50mL0.55molL﹣1 NaOH溶液在如下图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
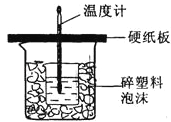
(1)从实验装置上看,图中尚缺少的一种玻璃仪器的名称是 。
(2)烧杯间填满碎纸条的作用是 。
(3)大烧杯上如不盖硬纸板,求得的中和热数值 (填“偏大、偏小、无影响”)。
(4)如果用60mL 0.50molL﹣1盐酸与50mL 0.55molL﹣1 NaOH溶液进行反应,与上述实验相比,所放出的热量 (填“相等、不相等”),所求中和热 (填“相等、不相等”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室利用下列装置模拟工业生产制备少量硝酸. 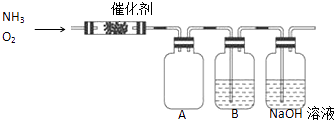
(1)B中试剂为 , NaOH溶液的作用是 .
(2)用过氧化钠与水反应制备氧气的化学方程式为 .
(3)实验时先用酒精喷灯预热催化剂,然后通入反应气体,当催化剂红热后撤离酒精喷灯,催化剂始终保持红热,温度可达到700℃以上.下列图示中,能够正确表示该反应过程能量变化的是 .
A.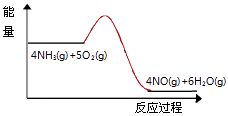
B.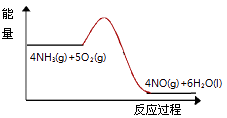
C.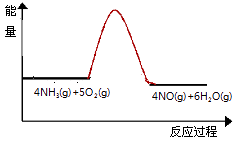
D.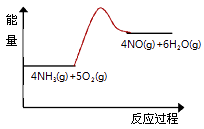
(4)已知2NO2(g)2NO(g)+O2(g)△H
NO2(g) ![]() N(g)+2O(g)
N(g)+2O(g)
NO(g) ![]() N(g)+O(g)
N(g)+O(g)
O2(g) ![]() 2O(g)
2O(g)
①计算反应的△H= .
②请解释高温下,氨气与氧气反应难以生成NO2的原因 .
(5)控制氨气和氧气的比例是制备硝酸的关键.
①当比例不合适时,A中不仅有红棕色气体产生,还伴有白烟.请用化学方程式表示白烟产生的原因 .
②欲使氨气尽可能完全转化为硝酸,理论上n(NH3):n(O2)的最佳比例为 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com