
【题目】信息时代产生的大量电子垃圾对环境造成了极大的威胁。某“变废为宝”学生探究小组将一批废弃的线路板简单处理后,得到含70%Cu、25%Al、4%Fe及少量Au、Pt等金属的混合物,并设计出如下制备硫酸铜晶体的路线:

回答下列问题:
(1)第①步Cu与酸反应的化学方程式为_______________________________________;
得到滤渣1的主要成分为________________。
(2)第②步加入H2O2的的离子方程式为______________________________________;使用H2O2的优点是______________________________________________;调节pH所产生的沉淀的化学式为______、______。
(3)用第③步所得CuSO4·5H2O制备无水CuSO4的方法是_______________________。
(4)由滤渣2制取Al2(SO4)3·18H2O,探究小组设计了三种方案:

上述三种方案中,可行方案是______,其中不可行方案的原因是______________________。
【答案】Cu+4HNO3(浓)== Cu(NO3)2+2H2O+2NO2 ↑ Au和pt H2O2+2Fe2++2H+=2Fe3++2H2O 绿色环保,无污染物产生 Al(OH)3 Fe(OH)3 加热蒸干或加浓硫酸吸水 乙和丙 甲中无法除去Fe3+
【解析】
(1)稀硫酸、浓硝酸混合酸后加热,Cu、Al、Fe发生反应生成Fe2+、Al3+、Cu2+;所以滤渣1 的成分是Pt和Au,滤液1中的离子是Fe2+、Al3+、Cu2+;铜与浓硝酸反应生成二氧化氮和硝酸铜,据此写出反应方程式;
(2)过氧化氢具有氧化性且被还原为水,无杂质无污染;过氧化氢把亚铁离子氧化为铁离子易于沉淀除去,调节溶液pH目的是铁离子和铝离子全部沉淀;
(3) 第③步由五水硫酸铜制备硫酸铜的方法应是在坩埚中加热脱水或加浓硫酸吸水;
(4) 根据实验方案过程分析制备晶体中是否含有杂质,使用的试剂作用,原料的利用率,原子利用率等因素分析判断。
(1) 稀硫酸、浓硝酸混合酸后加热,Cu、Al、Fe发生反应生成Fe2+、Al3+、Cu2+;所以滤渣1 的成分是Pt和Au,滤液1中的离子是Fe2+、Al3+、Cu2+;Cu与浓硝酸反应生成硝酸铜、二氧化氮和水,反应的化学方程式为:Cu+4HNO3(浓)== Cu(NO3)2+2H2O+2NO2 ↑;综上所述,本题答案是:Cu+4HNO3(浓)== Cu(NO3)2+2H2O+2NO2 ↑; Au和pt 。
(2) 第②步加H2O2的作用是将Fe2+氧化为Fe3+,离子方程式为H2O2+2Fe2++2H+=2Fe3++2H2O ;过氧化氢做氧化剂被还原后为水,不引入杂质,对环境无污染,绿色环保;调节溶液pH使铁离子和铝离子全部沉淀后过滤得到氢氧化铁、氢氧化铝沉淀和滤液硫酸铜;综上所述,本题答案是:H2O2+2Fe2++2H+=2Fe3++2H2O ;绿色环保,无污染物产生;Al(OH)3 ;Fe(OH)3。
(3) 第③步由五水硫酸铜制备硫酸铜的方法应是在坩埚中加热脱水或加浓硫酸吸水 ; 因此,本题正确答案是:加热脱水或加浓硫酸吸水。
(4)甲方案在滤渣中只加硫酸会生成硫酸铁和硫酸铝,冷却、结晶、过滤得到的硫酸铝晶体中混有大量硫酸铁杂质;
乙方案先在滤渣中加H2SO4,生成Fe2(SO4)3和Al2(SO4)3,再加Al粉和Fe2(SO4)3反应生成Al2(SO4)3,对滤液进行蒸发、冷却、结晶、过滤可得硫酸铝晶体;
丙方案先在滤渣中加NaOH和Al(OH)3反应生成NaAlO2,再在滤液中加H2SO4生成Al2(SO4)3,蒸发、冷却、结晶、过滤可得硫酸铝晶体;
所以上述三种方案中:甲方案制得的硫酸铝晶体中混有大量硫酸铁杂质,不可行,乙和丙可行;因此,本题正确答案是: 乙和丙;甲中无法除去Fe3+。


科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的值。下列说法不正确的是
A. 100mL l mol·L-1KClO溶液中,阴离子的数目大于0.1NA
B. 14g乙烯和丙烯混合气体中含有C—H共价键的数目为2NA
C. 5.6 g铁和6.4 g铜分别与0.1 mol氯气完全反应,转移的电子数相等
D. 含0.4molHNO3的浓硝酸与足量铜反应,转移的电子数等于0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水是资源的宝库:合理利用海水资源是当今是世界研究的重点课题。结合所学知识回答下列问题:
(1)列举一项海水中的能源:__________ ,海水中储量最大的资源是________ ,获得该资源最古老的方法是____________。
(2)海水中还有大量NaCl,MgCl2等盐类物质,从海水中获得纯净NaCl的分离提纯方法有过滤、______。
(3)目前世界上60%的镁是从海水提取的。海水提镁的主要流程如下:
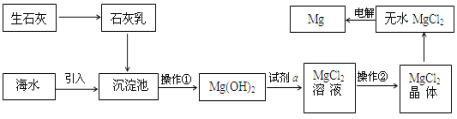
提示: MgCl2晶体的化学式为MgCl26H2O; MgO的熔点为2852℃,无水MgCl2的熔点为714℃。
①操作②的名称___________、冷却结晶、过滤。
②用氯化镁电解生产金属镁的化学方程式为:_____________________。
(4)粗盐提纯后的的卤水中含有大量的溴,从中提取溴的部分过程如下:

实验室模拟上述过程设计以下装置进行实验(所有橡胶制品已被保护,夹持装置已略去)

①A装置中通入a气体的目的是(用离子方程式表示) __________________________________________;
②A装置中先通入a气体后改通热空气。通入热空气的目的是______________________________________;
③B装置中b气体是SO2,目的是吸收富集Br2,此处离子方程式为___________________________________;
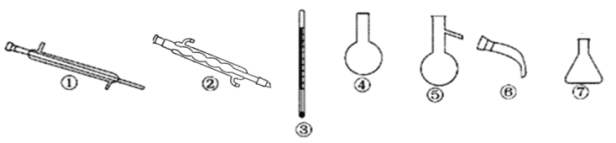
④向B装置中再次通入Cl2得到单质溴,对液体进行蒸馏,收集液溴。蒸馏应该选择下列仪器_____(填序号) 。
 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于组成生物体的化学元素,下列叙述不正确的是
A. 组成生物体的化学元素,可以分成大量元素和微量元素
B. 组成不同生物体的化学元素不仅种类大体相同含量也基本相同
C. 组成生物体的化学元素,没有一种是生物界所特有的
D. 组成玉米和家兔的最基本元素都是碳
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高聚物H可用于光刻工艺中,作抗腐蚀涂层。下面是高聚物H的合成路线:
![]()

Ⅱ.反应③属于加聚反应 Ⅲ.D属于高分子化合物,
请回答下列问题:
(1)反应⑤的条件是_______________;E的分子式为__________________;
(2)C中含有的官能团的名称是________________ ;
(3)芳香烃M与A的实验式相同,经测定M的核磁共振氢谱有5组峰且峰面积比为1:1:2:2:2,则M的结构简式为_____________ ;推测M可能发生的反应类型是___________;(写出一种即可)
(4)反应⑦的化学方程式为___________________________________________________ ;
(5)D和G反应生成H的化学方程式为___________________________________________ ;
(6)G的同分异构体中,与G具有相同官能团的芳香族化合物还有__________种(不考虑立体异构)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知酸性高锰酸钾溶液可以将FeSO4氧化,化学方程式为2KMnO4+10FeSO4+8H2SO4===K2SO4+2MnSO4+5Fe2(SO4)3+8H2O,现将一定量的硫酸酸化的高锰酸钾溶液与硫酸亚铁溶液混合,充分反应后再向所得溶液中加入KI溶液,混合溶液中铁离子的物质的量随加入的KI的物质的量的变化关系如图所示。则下列有关说法不正确的是( )
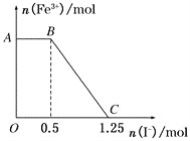
A. 图中AB段主要是高锰酸钾和碘化钾溶液反应
B. 图中BC段发生的反应为2Fe3++2I-===2Fe2++I2
C. 根据OC段的数据可知开始加入的高锰酸钾的物质的量为0.25 mol
D. 根据OC段的数据可知开始加入的硫酸亚铁的物质的量为1 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学——选修5:有机化学基础]端炔烃在催化剂存在下可发生偶联反应,称为Glaser反应。
2R—C≡C—H![]() R—C≡C—C≡C—R+H2
R—C≡C—C≡C—R+H2
该反应在研究新型发光材料、超分子化学等方面具有重要价值。下面是利用Glaser反应制备化合物E的一种合成路线:

回答下列问题:
(1)B的结构简式为______,D 的化学名称为______。
(2)①和③的反应类型分别为______、______。
(3)E的结构简式为______。用1 mol E合成1,4二苯基丁烷,理论上需要消耗氢气_______mol。
(4)化合物(![]() )也可发生Glaser偶联反应生成聚合物,该聚合反应的化学方程式为_____________________________________。
)也可发生Glaser偶联反应生成聚合物,该聚合反应的化学方程式为_____________________________________。
(5)芳香化合物F是C的同分异构体,其分子中只有两种不同化学环境的氢,数目比为3:1,写出其中3种的结构简式_______________________________。
(6)写出用2苯基乙醇为原料(其他无机试剂任选)制备化合物D的合成路线___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】石墨烯锂硫电池是一种高容量、长循环寿命、低成本及环境友好的新型二次电池,其工作原理如图所示,电池反应为2Li+nS![]() Li2Sn。下列说法错误的是
Li2Sn。下列说法错误的是

A. 放电时,Li+向正极移动
B. 充电时,A电极连接直流电源的正极
C. 充电时,每生成nmolS,外电路中流过2nmol电子
D. 放电时,正极上可发生反应2Li++Li2S4+2e-=2Li2S2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com