
 汽车作为一种现代交通工具正在进入千家万户,汽车尾气中含有CO、NO2等有毒气体,其污染问题也成为当今社会急需解决的问题.
汽车作为一种现代交通工具正在进入千家万户,汽车尾气中含有CO、NO2等有毒气体,其污染问题也成为当今社会急需解决的问题.分析 Ⅰ、依据化学方程式中元素化合价变化计算电子转移总数,每生成1molN2电子转移0.4xmol电子计算;
Ⅱ、(1)①依据化学方程式和平衡常数概念书写平衡常数表达式;
②增加甲醇产率需要平衡正向进行,依据平衡移动原理结合反应特征是气体体积减小的放热反应分析选项判断;
(2)依据热化学方程式和盖斯定律计算得到所需让化学方程式;
(3)CO-空气燃料电池中,燃料一氧化碳在负极失电子发生氧化反应生成二氧化碳,依据传导离子配平电荷守恒;
(4)①检验二氧化碳通常用澄清石灰水;
②甲醇被氧化生成二氧化碳,Co3+被还原生成Co2+,据此写出反应的离子方程式.
解答 解:I、2xCO+2NOx═2xCO2+N2,反应中生成1molN2电子转移2xmol电子,当转移电子物质的量为0.8x mol时,反应生成氮气0.2mol,标准状况下气体体积为:0.2mol×22.4L/mol=4.48L,
故答案为:4.48L;
II、(1)①CO(g)+2H2(g)?CH3OH(g)△H<0,反应的平衡常数K=$\frac{c(C{H}_{3}OH)}{c(CO)•{c}^{2}({H}_{2})}$,
故答案为:$\frac{c(C{H}_{3}OH)}{c(CO)•{c}^{2}({H}_{2})}$;
②反应是气体体积减小的放热反应,若容器容积不变,下列措施可增加甲醇产率:
A.升高温度,平衡逆向进行,甲醇产率减小,故A错误;
B.将CH3OH(g)从体系中分离,平衡正向进行,甲醇产率增大,故B正确;
C.充入He,使体系总压强增大,分压不变,平衡不动,故C错误;
D.再充入1mol CO和3mol H2 ,反应物浓度增大,平衡正向进行,甲醇产率增大,故D正确;
故答案为:BD;
(2)①CO(g)+2H2(g)═CH3OH(g)△H=-90.7kJ•mol-1
②2CH3OH(g)═CH3OCH3(g)+H2O(g)△H=-23.5kJ•mol-1
③CO(g)+H2O(g)═CO2(g)+H2(g)△H=-41.2kJ•mol-1
依据盖斯定律计算①×2+②+③得到:3CO(g)+3H2(g)═CH3OCH3(g)+CO2(g)的△H=-246.1KJ•mol-1,
故答案为:-246.1KJ•mol-1;
(3)CO-空气燃料电池中使用的电解质是搀杂Y2O3的ZrO2晶体,它在高温下能传导O2-,燃料一氧化碳在负极失电子发生氧化反应生成二氧化碳,用传导离子O2-,配平书写该电池负极的电极反应式为:CO-2e-+O2-=CO2,
故答案为:CO-2e-+O2-=CO2;
(4)①检验电解时产生的CO2气体,用澄清石灰水检验二氧化碳的存在,井穴板穴孔内应盛放澄清石灰水,
故答案为:澄清石灰水;
②甲醇被氧化生成二氧化碳,Co3+被还原生成Co2+,溶液呈酸性,则生成物中含有氢离子,所以该反应离子方程式为:6Co3++CH3OH+H2O=CO2↑+6Co2++6H+;
故答案为:6Co3++CH3OH+H2O=CO2↑+6 Co2++6H+.
点评 本题考查化学平衡的计算,题目难度中等,涉及化学平衡常数概念、氧化还原反应电子转移的分析应用,原电池原理、盖斯定律等知识点,根据盖斯定律书写热化学方程式,根据得失电子书写电极反应式,注意电极反应式要结合传导离子配平书写,试题培养了学生的灵活应用能力.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 0.1mol/L | B. | 0.05mol/L | C. | 0.2mol/L | D. | 无法计算 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
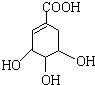 莽草酸是合成治疗禽流感的药物--达菲(Tamiflu)的原料之一.莽草酸是A的一种异构体.A的结构简式如下:
莽草酸是合成治疗禽流感的药物--达菲(Tamiflu)的原料之一.莽草酸是A的一种异构体.A的结构简式如下: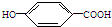 ),其反应类型是消去反应,化学方程式是
),其反应类型是消去反应,化学方程式是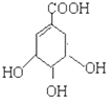 $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$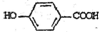 +2H2O.
+2H2O.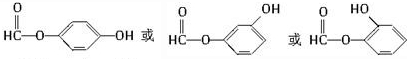 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
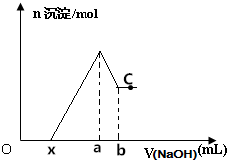 将某镁铝合金投入一定体积的稀盐酸中,待合金完全溶解后往溶液里滴入1mol/L的NaOH溶液,生成沉淀物质的量与加入NaOH溶液体积的关系如图所示,下列说法中错误的是( )
将某镁铝合金投入一定体积的稀盐酸中,待合金完全溶解后往溶液里滴入1mol/L的NaOH溶液,生成沉淀物质的量与加入NaOH溶液体积的关系如图所示,下列说法中错误的是( )| A. | C点对应的沉淀为Mg(OH)2 | |
| B. | Al的质量为27(b-a)×10-3 | |
| C. | 该合金与盐酸反应产生的H2为(a-x)×10-3mol | |
| D. | 由图可以确定x的取值范围为:0≤x<(4a-3b) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 将Na2O2加入含有Al3+、Fe2+的混合液中并微热,产生沉淀和气体的物质的量(mol)与加入Na2O2的物质的量(mol)的关系如图所示.下列说法不正确的是( )
将Na2O2加入含有Al3+、Fe2+的混合液中并微热,产生沉淀和气体的物质的量(mol)与加入Na2O2的物质的量(mol)的关系如图所示.下列说法不正确的是( )| A. | a=1.75 | |
| B. | b=0.5 | |
| C. | 原溶液中Al3+与Fe2+的物质的量之比为1:2 | |
| D. | 最后得到的沉淀为Fe(OH)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①或② | B. | ①或④ | C. | ②或③ | D. | ②或④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 是由一个1s轨道和一个2p轨道线性组合而成 | |
| B. | 等性sp杂化轨道中所含s、p的成分一样 | |
| C. | 等性sp杂化轨道有两个,一个能量升高,另一个能量降低,但总能量保持不变 | |
| D. | sp杂化轨道可与其他原子轨道形成σ键和π键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③⑤⑦ | B. | ②④⑥ | C. | ①④⑤⑥ | D. | ③④⑤⑥ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com