
【题目】用纯净的块状的碳酸钙与稀盐酸反应制取二氧化碳气体,请回答:
(1)实验过程如右图所示,分析判断:______段化学反应速率最快,_______段收集的二氧化碳气体最多。
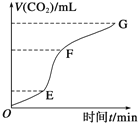
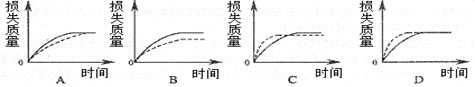
(2)上述反应中,A g块状碳酸钙跟足量盐酸反应,反应物消耗的质量随时间的变化曲线由实线表示,在相同的条件下,将B g(A>B)粉末状碳酸钙与足量的同浓度盐酸反应,反应物消耗的质量随时间的变化曲线由虚线表示。则最符合实际情况的图像是________。
(3)为了减缓上述反应的速率,欲向溶液中加入下列物质,你认为可行的是_________。
A.蒸馏水 B.氯化钠 C.硝酸钾溶液 D.浓盐酸 E.降温 F加入MnO2
科目:高中化学 来源: 题型:
【题目】硼元素、钙元素、铜元素在化学战有很重要的地位,单质及其化合物在工农业生产和生活中有广泛的应用.
(1)已知CaC2与水反应生成乙炔.请回答下列问题:
①将乙炔通入 [Cu(NH3)2]Cl溶液中生成Cu2C2红棕色沉淀, Cu+基态核外电子排布式为 ______ .
②CaC2中![]() 与
与![]() 互为等电子体. 1mol
互为等电子体. 1mol![]() 中含有的π键数目为 ______ .
中含有的π键数目为 ______ .
③乙炔与氢氰酸反应可得丙烯睛(CH2=CHC=N),丙烯腈分子中碳原子轨道杂化类
型是 ______ ,构成丙烯腈元素中第一电离能最大的是 ______.
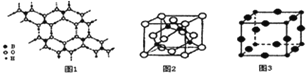
(2)硼酸 (H3BO3)是一种片层状结构的白色晶体,层内的H3BO3分子间通过氢健相连(如上图1),则1mol H3BO3的晶体中有 ______ mol氢键.硼酸溶于水生成弱电解质一水合硼酸B(OH)3·H2O,它电离生成少量[B(OH)4]-和H+,则[B(OH)4]-的空间构型为 ______
(3)某M原子的外围电子排布式为3s23p5,铜与M形成化合物的晶胞如上图2所示![]() 黑点代表铜原子,空心圆代表M原子
黑点代表铜原子,空心圆代表M原子![]() .
.
![]() 该晶体化学式为 ______ .
该晶体化学式为 ______ .
![]() 已知铜和M的电负性分别为1.9和3.0,则铜与M形成的化合物属于 ______
已知铜和M的电负性分别为1.9和3.0,则铜与M形成的化合物属于 ______ ![]() 填“离子”、“共价”
填“离子”、“共价”![]() 化合物.
化合物.
(4)Cu3N的晶胞结构如右上图3, N3-的配位数为 ______ ,Cu+半径为apm,N3-半径为bpm,Cu3N的密度为 ______ g·cm-3。(阿伏加德罗常数用![]() 表示)
表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨广泛用于生产化肥、制冷剂等方面。回答下列问题:
(1)实验室可用下图所示装置合成氨。

①合成氨时,还原铁粉的作用是________________。
②锥形瓶中盛有一定量的水,并滴有几滴酚酞试剂,反应—段时间后,锥形瓶中溶液变红,则气体X的成分为N2、水蒸气、____________和_________________。
⑵最近斯坦福大学研究人员发明了一种SUNCAT的锂循环系统,可持续合成氨,其原理如图所示。

①图中反应Ⅱ的化学方程式为____________________。
②反应Ⅲ中能量转化的方式是__________________(填“电能转变为化学能”或“化学能转变为电能”)。
(3)液氨可用作制冷剂,液氨气化时__________(填“释放”或“吸收”)能量;液氨泄漏遇明火会发生爆炸。已知部分化学键的键能数据如下表所示:
共价键 | N-H | O=O | N≡N | O-H |
键能/kJ·mol-1 | 391 | 498 | 946 | 463 |
则反应 4NH3(g)+3O2(g)=2N2(g)+6H2O(g)的反应热△H=____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丙烯腈(CH2=CHCN)是一种重要的化工原料,工业上可用“丙烯氨氧化法”生产,主要副产物有丙烯醛(CH2=CHCHO)和乙腈(CH3CN)等,回答下列问题:
(1)以丙烯、氨、氧气为原料,在催化剂存在下生成丙烯腈(C3H3N)和副产物丙烯醛(C3H4O)的热化学方程式如下:
①C3H6(g)+NH3(g)+ 3/2O2(g)=C3H3N(g)+3H2O(g) ΔH=-515kJ/mol
①C3H6(g)+ O2(g)=C3H4O(g)+H2O(g) ΔH=-353kJ/mol
两个反应在热力学上趋势均很大,其原因是________;有利于提高丙烯腈平衡产率的反应条件是________;提高丙烯腈反应选择性的关键因素是________。
(2)图(a)为丙烯腈产率与反应温度的关系曲线,最高产率对应温度为460℃。低于460℃时,丙烯腈的产率________(填“是”或者“不是”)对应温度下的平衡产率,判断理由是________;高于460℃时,丙烯腈产率降低的可能原因是________(双选,填标号)
A.催化剂活性降低 | B.平衡常数变大 | C.副反应增多 | D.反应活化能增大 |

(3)丙烯腈和丙烯醛的产率与n(氨)/n(丙烯)的关系如图(b)所示。由图可知,最佳n(氨)/n(丙烯)约为,理由是_______________。进料氨、空气、丙烯的理论体积约为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用CaSO4代替O2与燃料CO反应,既可以提高燃烧效率,又能得到高纯CO2,是一种高效、清洁、经济的新型燃烧技术,反应①为主反应,反应②和③为副反应。
①1/4CaSO4(s)+CO(g)![]() 1/4CaS(s)+CO2(g) △H1=-47.3kJ/mol
1/4CaS(s)+CO2(g) △H1=-47.3kJ/mol
②CaSO4(s)+CO(g)![]() CaO(s)+ CO2(g)+ SO2(g) △H2=+210.5kJ/mol
CaO(s)+ CO2(g)+ SO2(g) △H2=+210.5kJ/mol
③CO(g)![]() 1/2C(s)+1/2CO2(g) △H3=-86.2kJ/mol
1/2C(s)+1/2CO2(g) △H3=-86.2kJ/mol
反应①~③的平衡常数的对数lgK随反应温度T的变化曲线见图,结合各反应的△H,归纳lgK~T曲线变化规律:

a)___;b)___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,某容积不变的密闭容器内存在下列平衡:2HI(g)![]() H2(g)+I2(g);则下列有关说法正确的是
H2(g)+I2(g);则下列有关说法正确的是
A. 如改变体系温度,体系颜色不一定发生变化
B. 如仅仅改变浓度这一条件,使得体系颜色加深,则上述平衡一定正移
C. 继续充入HI气体,达到平衡后, 体系颜色加深
D. 温度不变时,当体系颜色变浅,则正反应速率和逆反应速率都将减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】地球上的元素大多数是金属,Na、Mg、Al是常见的主族金属元素,Fe和Cu是常见的过渡金属元素。它们在化学中占有极其重要的地位。
(1)①Na、Mg、Al三种元素第一电离能由大到小的顺序为___________
②金属钠原子的堆积方式是体心立方,其配位数为___________
(2)选修三课本第42页实验2-2:向盛有硫酸铜水溶液的试管里加入氨水,首先形成难溶物,继续加氨水,难溶物溶解,得到深蓝色的透明溶液;若加入极性较小的溶剂(如乙醇),将析出深蓝色的晶体。
①硫酸铜溶液中呈___________色的物质是水合铜离子,请写出它的结构简式,并标明其中配位键___________
②请写出难溶物溶解得到深蓝色的透明溶液的离子方程式___________
③结构测定的实验证明,无论在氨水溶液中还是在晶体中,深蓝色都是由于存在某种离子,1mol该离子含有___________molσ键。
(3)写出少量Na2O2与氯化铁溶液反应的离子反应方程式:___________(要求:仅写1个总的离子方程式)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为乙酸丁酯制备的实验装置,下列说法正确的是

A.玻璃导管的主要作用是平衡试管内外压强
B.该装置适用于乙酸乙酯的制备
C.加入过量乙酸可以提高丁醇的转化率
D.分离提纯乙酸丁酯的方法是将混合物直接分液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com