
【题目】在体积固定的密闭容器中,进行的可逆反应为A(固) +3B(气)![]() 3C(气)。下列叙述中表明可逆反应一定达到平衡状态的是( )
3C(气)。下列叙述中表明可逆反应一定达到平衡状态的是( )
①C的生成与分解速率相等 ②单位时间内生成amolA和3amolB
③B的浓度不再变化 ④混合气体总的物质的量不再发生变化
⑤A、B、C的物质的量之比为1:3:3 ⑥混合气体的密度不再变化
A. ①②③B. ①③④⑥C. ①③⑥D. ①③④⑤
【答案】C
【解析】
①C的生成速率与C的分解速率相等,说明正逆反应速率相等,①能说明反应达到平衡状态;
②化学反应速率之比等于化学计量数之比,无论是否达到平衡状态,都存在单位时间生成amolA,同时生成3amolB,②不能说明反应达到平衡状态;
③当反应达到化学平衡状态时,各物质的浓度不变,③能说明反应达到平衡状态;
④气体反应物与气体生成物的化学计量数之和相等,无论是否达到平衡状态,混合气体总的物质的量都不变,④不能说明反应达到平衡状态;
⑤平衡时各物质的物质的量取决于起始配料比以及转化的程度,A、B、C物质的量之比为1:3:3不能作为判断是否达到平衡状态的依据;
⑥A为固体,当反应达到平衡状态时,气体的总质量不变,混合气体的密度不再变化,⑥能说明反应达到平衡状态;
答案选C。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列叙述中不正确的是
A. 0.1mo1·L-1NH4HS溶液中有:c(NH4+)<c(HS-)+c(S2-)+c(H2S)
B. 25℃时,将a mo1·L-1的氨水与0.01 mo1·L-1的盐酸等体积混合后,c(NH4+)=c(Cl-),则NH3·H2O的电离常数为![]()
C. 等浓度的HCN和NaCN混合溶液中有:2c(Na+)=c(CN-)+c(HCN)
D. 等pH的HA和HB溶液,分别与一定浓度的氢氧化钠溶液完全中和,HA消耗的氢氧化钠溶液体积多,则可证明酸性HA<HB
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y两元素是同周期的非金属元素,如果X 原子半径比Y的大,下面说法正确的是 ( )
A.最高价氧化物对应的水化物的酸性,X的比Y的强
B.X的非金属性比Y的强
C.X的阴离子比Y的阴离子还原性强
D.X的气态氢化物比Y的稳定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ClO2是一种强氧化性气体(高浓度时呈红黄色,低浓度时呈黄色),在消毒和果蔬保鲜等方面应用广泛。某兴趣小组通过下图所示装置(夹持装置略)对其进行制备、收集、吸收并制取NaClO2。
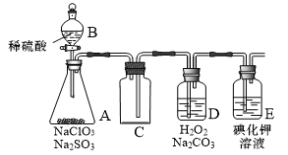
(1)仪器A的名称是______。
(2)图中装置有一明显错误,请指出:______。
(3)打开B的活塞,A中有ClO2生成,D中吸收ClO2后生成NaClO2和NaHCO3,写出D中所发生反应的离子方程式:______。
(4)E中溶液出现黄色能否说明ClO2未被H2O2和Na2CO3的混合溶液充分吸收,判断并说明理由:______。
(5)写出一种提高ClO2吸收率的方法:______。
(6)E装置吸收逸出的少量ClO2气体后所得溶液(pH为5.5~6.5)中存在少量ClO2—,当pH≤2.0时,ClO2—能被I—还原。请补充完整检验E装置溶液中存在少量ClO2—的实验方案:取一定体积E装置中的溶液于分液漏斗中,______,则溶液中存在ClO2—。(实验中须使用的试剂有:CCl4、稀硫酸、淀粉溶液)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图中横坐标为加入反应物的物质的量,纵坐标为产生沉淀的物质的量。下列反应对应的曲线错误的是
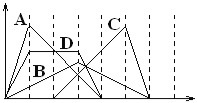
A. 向NaAlO2溶液中滴入HCl至过量
B. 向澄清石灰水中通入CO2至过量
C. 向含有盐酸的A1C13溶液中滴入NaOH溶液至过量。
D. 向含有等物质的量的Ca(OH)2、KOH的混合溶液中通入CO2至沉淀消失
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是
A. NO2、SO2、BF3、NCl3分子中没有一个分子中原子的最外层电子都满足8电子稳定结构
B. PH3和CH4都是正四面体形分子且键角都为109°28′
C. NH3分子中有一对未成键的孤电子对,它对成键电子的排斥作用较强
D. NH4+的电子式为 ,离子呈平面正方形结构
,离子呈平面正方形结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将15.2 g 铜和镁组成的混合物加入250 mL4.0 mol L-1的稀硝酸中,固体完全溶解,生成的气体只有NO。向所得溶液中加入1.0 L NaOH溶液,此时金属离子恰好沉淀完全,沉淀质量为25.4 g,下列说法不正确的是
A. 原固体混合物中,Cu和Mg的物质的量之比为2:1
B. 氢氧化钠溶液的浓度为0.8 mol·L-1
C. 固体溶解后的溶液中硝酸的物质的量为0.1mol
D. 生成的NO气体在标况下的体积为4.48L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向10 mL0.1 mol·L-1NH4Al(SO4)2溶液中,滴加等浓度Ba(OH)2溶液x mL。下列叙述正确的是
A. x=10时, 溶液中有NH4+、AlO2-、SO42-, 且c(NH4+)>c(SO42-)
B. x=10时, 溶液中有NH4+、Al3+、SO42-, 且c(NH4+)>c(Al3+)
C. x=30时, 溶液中有Ba2+、AlO2-、OH-, 且c(OH-)<c(AlO2-)
D. x=30时, 溶液中有Ba2+、Al3+、OH-, 且c(OH-)=c(Ba2+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化铈(CeO2)是一种重要的稀土氧化物。平板电脑显示屏生产过程中有大量的废玻璃粉末(含SiO2、Fe2O3、CeO2以及其他少量可溶于稀酸的物质)产生。某课题组以此粉末为原料回收铈,设计实验流程如下:
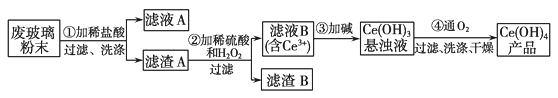
(1)滤渣A的主要成分是_____________;洗涤滤渣A除去的阳离子主要是________(填离子符号),检验该离子是否洗净的操作是________________________;
(2)步骤②中反应的离子方程式是_____________________;
(3)萃取是分离稀土元素的常用方法。已知化合物TBP作为萃取剂能将铈离子从水溶液中萃取出来,TBP________(填“能”或“不能”)与水互溶。实验室进行萃取操作时用到的主要玻璃仪器有________、烧杯、玻璃棒、量筒等;
(4)步骤④中反应化学方程式为______________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com