
利用下列反应不能制得括号中纯净物质的是
A.乙烯与水反应(乙醇)
B.乙烯与氯气反应(1,2-二氯乙烷)
C.液溴与苯用溴化铁作催化剂反应(溴苯)
D.等物质的量的氯气与乙烷在光照条件下反应(氯乙烷)
科目:高中化学 来源: 题型:
在加入铝粉能放出氢气的溶液中,下列各组离子可能大量共存的是 ( )
A.NH NO CO Na+ B.Na+ Ba2+ Mg2+ HCO
C.NO K+ AlO OH- D.NO Mg2+ K+ Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
两种微粒含有相同的质子数和电子数,这两种微粒可能是
①两种不同的原子;②两种不同元素的原子;③一种原子和一种分子;④一种原子和一种离子;⑤两种不同分子;⑥一种分子和一种离子;⑦两种不同阳离子;⑧两种不同阴离子;⑨一种阴离子和一种阳离子
A.①③⑤⑥⑦⑧ B.①③⑤⑦⑧
C.①③④⑤⑦ D.全部都是
查看答案和解析>>
科目:高中化学 来源: 题型:
在实验室中可用下图所示装置制取氯酸钾、次氯酸钠和探究氯水的性质。
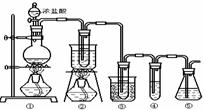
图中: ①为氯气发生装置;②的试管里盛有15mL 30% KOH 溶液.并置于热水浴中; ③的试管里盛有15mL 8 % NaOH 溶液.并置于冰水浴中; ④的试管里加有紫色石蕊试液; ⑤为尾气吸收装置。
请填写下列空白:[来源:Zxxk.Com]
⑴制取氯气时,在烧瓶里加入一定量的二氧化锰,通过______(填写仪器名称)向烧瓶中加入适量的浓盐酸。实验时为了除去氯气中的氯化氢气体,可在①与②之间安装盛有_________(填写下列编号字母)的净化装置。
 A.碱石灰 B.饱和食盐水 C.浓硫酸 D.饱和碳酸氢钠溶液
A.碱石灰 B.饱和食盐水 C.浓硫酸 D.饱和碳酸氢钠溶液
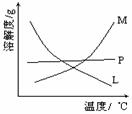
⑵比较制取氯酸钾和次氯酸钠的条件.二者的差异是 。反应完毕经冷却后,②的试管中有大量晶体析出。右图中符合该晶体溶解度曲线的是_______(填写编号字母);从②的试管中分离出该晶体的方法是 (填写实验操作名称)。
(3)本实验中制取次氯酸钠的离子方程式是: 。
(4)实验中可观察到④的试管里溶液的颜色发生了如下变化,请填写下表中的空白:
| 实验现象 | 原因 |
| 溶液最初从紫色逐渐变为 色 | 氯气与水反应生成的H+使石蕊变色 |
| 随后溶液逐渐变为无色 | ______________________________________ |
| 然后溶液从无色逐渐变为 色 | _________________________________________ |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是
A.氧化还原反应一定有氧元素参加
B.失电子难的原子其得电子的能力一定强
C.金属单质只具有还原性
D.失电子越多,该物质的还原性就越强
查看答案和解析>>
科目:高中化学 来源: 题型:
火法炼铜首先要焙烧黄铜矿,反应为:CuFeS2+O2 Cu2S+FeS+SO2 则下列说法正确的是
Cu2S+FeS+SO2 则下列说法正确的是
A.CuFeS2既是氧化剂又是还原剂,硫元素既被氧化又被还原
B.每生成1molSO2转移6mol电子
C.SO2既是氧化产物又是还原产物,FeS只是还原产物
D.每转移1.2 mol电子,有0.3 mol氧气被还原
查看答案和解析>>
科目:高中化学 来源: 题型:
下表为长式周期表的一部分,其中的序号代表对应的元素。
| ① | |||||||||||||||||
| ② | ③ | ④ | ⑤ | ⑥ | |||||||||||||
| ⑦ | ⑧ | ||||||||||||||||
|
| ⑨ | ⑩ |
(1)写出上表中元素⑨原子的外围电子排布式__________。
(2)在元素③与①形成的水果催熟剂气体化合物中,元素③的杂化方式为__________杂化;元素⑦与⑧形成的化合物的晶体类型是__________。
(3)元素④的第一电离能__________元素⑤(填写“>”“=”或“<”)的第一电离能;元素④与元素①形成的最简单的X分子的空间构型为__________。请写出与元素④的单质互为等电子体分子、离子的化学式__________(各写一种)。
(4)在测定元素①与⑥形成化合物的相对分子质量时,实验测得的值一般高于理论值的主要原因是__________。
 (5)元素④的最高价氧化物对应的水化物稀溶液与元素⑦的单质反应时,元素④被还原到最低价,该反应的化学方程式为__________。
(5)元素④的最高价氧化物对应的水化物稀溶液与元素⑦的单质反应时,元素④被还原到最低价,该反应的化学方程式为__________。
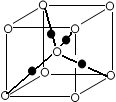
(6)将过量的X通入含有元素⑩的蓝色硫酸盐溶液中,反应的离子方程式为__________;元素⑩的某种氧化物的晶体结构如图所示,其中实心球表示元素⑩原子,则一个晶胞中所包含的氧原子数目为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
矿石中金的含量很低,金的性质又相当稳定,只能用湿法冶金——氰化法提炼,即采用稀的NaCN溶液处理已粉碎的矿石,把少量的金浸入溶液中,然后用金属锌作还原剂将金从溶液中置换析出。其反应原理为
①4Au+8NaCN+O2+2H2O 4Na[Au(CN)2]+4NaOH;
4Na[Au(CN)2]+4NaOH;
②2Na[Au(CN)2]+Zn 2Au+Na2[Zn(CN)4]。
2Au+Na2[Zn(CN)4]。
以下有关氰化法提炼金的说法中正确的是( )
A.Na[Au(CN)2]不溶于水
B.化合物Na[Au(CN) 2]中金元素的化合价为+1
C.金元素在地壳中能以化合态的形式存在
D.在提炼过程中含金元素的物质始终作氧化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
请按要求写出下列化学方程式
①乙烯使硫酸酸化的高锰酸钾溶液褪色(乙烯被氧化为二氧化碳,高锰酸钾被还原为硫酸锰MnSO4)。
②甲苯在浓硫酸作催化剂的条件下与浓硝酸反应生成三硝基甲苯。
③乙醇使硫酸酸化的重铬酸钾溶液变色(乙醇被氧化为乙酸,重铬酸钾被还原为硫酸铬)。
④乙烯与氧气在银作催化剂的条件下反应生成环氧乙烷,且该反应的原子利用率为?
⑤对苯甲二甲酸与乙二醇缩聚反应生成聚酯纤维(涤纶)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com