

 Cl2””””I£”””«””
Cl2””””I£”””«”” Cl2””I2”«2IO3-”«5Cl2
Cl2””I2”«2IO3-”«5Cl2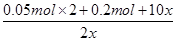 £½8
£½8

 Ó¦ÓĆĢāĢģĢģĮ·ĖÄ“Ø“óѧ³ö°ęÉēĻµĮŠ“š°ø
Ó¦ÓĆĢāĢģĢģĮ·ĖÄ“Ø“óѧ³ö°ęÉēĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
| A£®ĮņŌŖĖŲ±»»¹Ō |
| B£®¶žŃõ»ÆĮņŹĒ»¹Ō¼Į |
| C£®¹żŃõ»ÆÄĘ¼ČŹĒŃõ»Æ¼ĮÓÖŹĒ»¹Ō¼Į |
| D£®¶žŃõ»ÆĮņ¼Č²»ŹĒŃõ»Æ¼ĮŅ²²»ŹĒ»¹Ō¼Į |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
| A£®Ņ»¶ØÓŠµāĄė×Ó”””””””” | B£®æÉÄÜŗ¬ĢśĄė×Ó |
| C£®æÉÄÜÓŠĀČĄė×Ó | D£®²»ŗ¬ĻõĖįøłĄė×Ó |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
A£® | B£® | C£® | D£® |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
| Ń”Ļī | ²Ł ×÷ | ĻÖ Ļó | ½į ĀŪ |
| A | ĻņČÜŅŗXÖŠµĪ¼ÓNaOHĻ”ČÜŅŗ£¬½«ŹŖČóµÄŗģÉ«ŹÆČļŹŌÖ½ÖĆÓŚŹŌ¹ÜæŚ | ŹŌÖ½²»±äĄ¶ | ČÜŅŗXÖŠĪŽNH |
| B | ½«ÉŁĮæµÄäåĖ®µĪČėFeCl2”¢NaIµÄ»ģŗĻČÜŅŗÖŠ£¬ŌŁµĪ¼ÓCCl4£¬Õńµ“”¢¾²ÖĆ£¬ĻņÉĻ²ćČÜŅŗÖŠµĪ¼ÓKSCNČÜŅŗ | ÉĻ²ćČÜŅŗ²»±äŗģ£¬ ĻĀ²ćČÜŅŗ×ĻŗģÉ« | Ńõ»ÆŠŌ£ŗBr2£¾Fe3+£¾I2 |
| C | ½«Ė®ÕōĘųĶعż×ĘČȵÄĢś·Ū | ·ŪÄ©±äŗģ | ĢśÓėĖ®ŌŚøßĪĀĻĀ·¢Éś·“Ó¦ |
| D | ĻņĘÆ°×·ŪÉĻ¼ÓČė½ĻÅصÄŃĪĖį£¬½«ŹŖČóµķ·Ūµā»Æ¼ŲŹŌÖ½ÖĆÓŚŹŌ¹ÜæŚ | ²śÉśĘųÅŻ£¬ŹŌÖ½Ī“±äĄ¶ | ĘÆ°×·ŪŅŃ¾Ź§Š§ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
| A£®°×É«³ĮµķŹĒCuI2£¬×ŲÉ«ČÜŅŗŗ¬ÓŠI2 |
| B£®µĪ¼ÓKIČÜŅŗŹ±£¬×ŖŅĘ1 molµē×ÓŹ±Éś³É1 mol°×É«³Įµķ |
| C£®ĶØČėSO2Ź±£¬SO2ÓėI2·“Ó¦£¬I2×÷»¹Ō¼Į |
| D£®ÉĻŹöŹµŃéĢõ¼žĻĀ£¬ĪļÖŹµÄŃõ»ÆŠŌ£ŗI2>Cu2£«>SO2 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
 Cl2£«2KIO3£¬ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ
Cl2£«2KIO3£¬ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ| A£®ĻņKClO3ČÜŅŗÖŠµĪ¼ÓAgNO3ČÜŅŗµĆµ½°×É«AgCl³Įµķ |
| B£®·“Ó¦¹ż³ĢÖŠI2ÖĆ»»³öCl2£¬ÓÉ“ĖæÉĶʶĻ·Ē½šŹōŠŌI£¾CI |
| C£®KClO3ŗĶKIO3¾łŹōÓŚĄė×Ó»ÆŗĻĪļ£¬¶¼Ö»ŗ¬ÓŠĄė×Ó¼ü |
| D£®ÖʱøKIO3µÄ·“Ó¦ÖŠĀČŌŖĖŲ±»»¹Ō |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
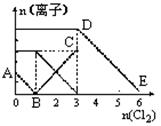
| A£®Ļ߶ĪBC“ś±ķFe3+ĪļÖŹµÄĮæµÄ±ä»ÆĒéæö |
| B£®Ō»ģŗĻČÜŅŗÖŠn(FeBr2)£½3mol |
| C£®µ±ĶØČėCl22molŹ±£¬ČÜŅŗÖŠŅŃ·¢ÉśµÄĄė×Ó·“Ó¦æɱķŹ¾ĪŖ£ŗ 2Fe2++2I-+2C12£½2Fe3++I2+4Cl- |
| D£®ŌČÜŅŗÖŠn(Fe2+):n(I-):n(Br-)£½3:1: 2 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
| A£®Co2O3 + 6 HCl£½2CoCl2 + Cl2”ü+ 3H2O |
| B£®Cl2 + FeI2 = FeCl2 + I2 |
| C£®3 Cl2 + 6 FeI2 = 2FeCl3 + 4 FeI3 |
| D£®2Fe3+ + 2I”Ŗ = 2Fe2++ I2 |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com