
”¾ĢāÄæ”æĢ¼Ėį¼×ŅŅõ„(CH3OCOOC2H5)ŹĒŅ»ÖÖĄķĻėµÄļ®µē³ŲÓŠ»śµē½āŅŗ”£Éś³ÉĢ¼Ėį¼×ŅŅõ„µÄŌĄķĪŖ£ŗC2H5OCOOC2H5(g)+ CH3OCOOCH3(g)![]() 2 CH3OCOOC2H5(g)£®ĘäĖūĢõ¼žĻąĶ¬£¬CH3OCOOCH3µÄĘ½ŗā×Ŗ»ÆĀŹ(¦Į)ÓėĪĀ¶Č(T)£¬·“Ó¦ĪļÅä±Č£ØR=n(C2H5OCOOC2H5):n(CH3OCOOCH3)£©µÄ¹ŲĻµČēĻĀĶ¼ĖłŹ¾£®ČżÖÖ·“Ó¦ĪļÅä±Č·Ö±šĪŖ1:1£¬2:1£¬3:1£®ĻĀĮŠĖµ·Ø²»ÕżČ·µÄŹĒ( )
2 CH3OCOOC2H5(g)£®ĘäĖūĢõ¼žĻąĶ¬£¬CH3OCOOCH3µÄĘ½ŗā×Ŗ»ÆĀŹ(¦Į)ÓėĪĀ¶Č(T)£¬·“Ó¦ĪļÅä±Č£ØR=n(C2H5OCOOC2H5):n(CH3OCOOCH3)£©µÄ¹ŲĻµČēĻĀĶ¼ĖłŹ¾£®ČżÖÖ·“Ó¦ĪļÅä±Č·Ö±šĪŖ1:1£¬2:1£¬3:1£®ĻĀĮŠĖµ·Ø²»ÕżČ·µÄŹĒ( )
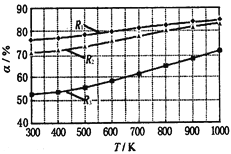
A.øĆ·“Ó¦”÷H £¾ 0
B.R1¶ŌÓ¦µÄ·“Ó¦ĪļÅä±ČĪŖ3:1
C.650”ę£¬·“Ó¦ĪļÅä±ČĪŖ1:1Ź±£¬Ę½ŗā³£ŹżK = 6
D.øĆ·“Ó¦ĪŖČ”“ś·“Ó¦
”¾“š°ø”æC
”¾½āĪö”æ
A£®ŌŚĘäĖüĢõ¼ž²»±äµÄĒéæöĻĀ£¬ÉżøßĪĀ¶Č£¬CH3OCOOCH3µÄĘ½ŗā×Ŗ»ÆĀŹŌö“ó£¬ĖµĆ÷Ę½ŗāÕżĻņŅĘ¶Æ”£øł¾ŻĘ½ŗāŅʶÆŌĄķ”£ÉżøßĪĀ¶Č£¬»ÆŃ§Ę½ŗāĻņĪüČČ·½ĻņŅĘ¶Æ”£ĖłŅŌÕż·“Ó¦·½ĻņŹĒĪüČČ·“Ó¦”£øĆ·“Ó¦”÷H £¾ 0£¬ÕżČ·”£
B£®øĆ·“Ó¦Ē°ŗóĘųĢåµÄ·Ö×ÓŹż²»±ä£¬ŌŚĘäĖüĢõ¼ž²»±äµÄĒéæöĻĀ£¬Ōö¼ÓijŅ»·“Ó¦ĪļµÄ±ČĄż£¬æÉŅŌĢįøßĘäĖü·“Ó¦ĪļµÄ×Ŗ»ÆĀŹ£¬¶ųĖü±¾ÉķµÄ×Ŗ»ÆĀŹ·“¶ų½µµĶ”£ĖłŅŌæÉŌö“ó·“Ó¦ĪļÖŠC2H5OCOOC2H5µÄÅØ¶Č£Ø»ņ±ČĄż£©Ą“ĢįøßCH3OCOOCH3µÄĘ½ŗā×Ŗ»ÆĀŹ”£ÓÉÓŚR1µÄ×Ŗ»ÆĀŹ×īøߣ¬ĖłŅŌR1¶ŌÓ¦µÄ·“Ó¦ĪļÅä±ČĪŖ3:1£¬ÕżČ·”£
C£®650”ę£¬·“Ó¦ĪļÅä±ČĪŖ1:1Ź±£¬CH3OCOOCH3µÄĘ½ŗā×Ŗ»ÆĀŹ¦ĮĪŖ60£„£®ÉčČŻĘ÷µÄČŻ»żĪŖVL£¬ŌņæŖŹ¼Ź±ø÷ĪļÖŹµÄÅضČĪŖ£ŗC(C2H5OCOOC2H5)=1/V£¬ C(CH3OCOOCH3)=1/V£¬ C(CH3OCOOC2H5)=0£®ŌŚĘ½ŗāŹ±C(C2H5OCOOC2H5)=0.4/V£¬ C(CH3OCOOCH3)=0.4/V£¬ C(CH3OCOOC2H5)=1.2/V£¬K£½(1.2/V)2/£Ø0.4/V£©2=9£¬“ķĪó”£
D£®ÓÉ·“Ó¦·½³ĢŹ½æÉ擳öøĆ·“Ó¦ĪŖČ”“ś·“Ó¦£¬ÕżČ·”£
¹ŹŃ”C”£


 æŚĖćĢāæؼÓÓ¦ÓĆĢā¼ÆѵĻµĮŠ“š°ø
æŚĖćĢāæؼÓÓ¦ÓĆĢā¼ÆѵĻµĮŠ“š°ø ×ŪŗĻ×Ō²āĻµĮŠ“š°ø
×ŪŗĻ×Ō²āĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĒė°“ĢāÄæŅŖĒóĶź³ÉĻąÓ¦ĪŹĢā£ŗ
£Ø1£©K2FeO4ŌŚČÜŅŗÖŠµÄµēĄė·½³ĢŹ½ĪŖ_____________”£
£Ø2£©³żČ„ŌÓÖŹ(ĄØŗŵÄĪļÖŹĪŖŌÓÖŹ)Na2CO3ČÜŅŗ(NaHCO3) Ąė×Ó·½³ĢŹ½ĪŖ_________________________”£
£Ø3£©æÉČÜŠŌĢśŃĪÓė×ćĮæ°±Ė®·“Ó¦µÄĄė×Ó·½³ĢŹ½_______________________________________”£
£Ø4£©Ńõ»ÆĢśÓėĒæĖį·“Ó¦µÄĄė×Ó·“Ó¦·½³ĢŹ½£ŗ_____________________________________”£
£Ø5£©ÅäĘ½Ńõ»Æ»¹Ō·“Ó¦£ŗ”õC + ”õK2Cr2O7 + ”õH2SO4(Ļ”) ”÷”õCO2”ü+”õK2SO4+”õCr2(SO4)3+”õH2O___
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠ·½³ĢŹ½±ķ“ļ£¬ÕżČ·µÄŹĒ
A.Ģ¼ĖįĒāÄĘČÜÓŚĖ®µÄµēĄė·½³ĢŹ½£ŗNaHCO3![]() Na£«£«H£«£«CO32£
Na£«£«H£«£«CO32£
B.ĀČĘųÓėĖ®·“Ó¦£ŗCl2 + H2O![]() 2H+ + Cl- + ClO-
2H+ + Cl- + ClO-
C.ĒāŃõ»Æ±µČÜŅŗÓėĻ”ĮņĖį»ģŗĻ£ŗBa2++ OH- + SO42- + H+ = BaSO4”ż + H2O
D.ĻņFeI2ČÜŅŗÖŠĶØČėÉŁĮæµÄĀČĘų£ŗ2I-£«Cl2 = 2Cl-£«I2
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æij»ÆѧŠ”×éŠčŅŖ480 mL 0.1000 mol/LµÄNaOHČÜŅŗ”£ÓūŌŚŹµŃéŹŅÓĆ¹ĢĢåÉÕ¼īÅäÖĘ”£Ēė»Ų“šĻĀĮŠĪŹĢā£ŗ

£Ø1£©±¾ŹµŃéŠčÓĆĶŠÅĢĢģĘ½³ĘĮæÉÕ¼īµÄÖŹĮæĪŖ_____g”£
£Ø2£©ÅäÖĘ¹ż³ĢÖŠ£¬²»ŠčŅŖµÄŅĒĘ÷£ØĢīŠ““śŗÅ£©________________”£
a£®ÉÕ± b£®ĄäÄż¹Ü c£®²£Į§°ō d£®1000mLČŻĮæĘæ e£®Ā©¶· f£®½ŗĶ·µĪ¹Ü
£Ø3£©øł¾ŻŹµŃéŠčŅŖŗĶ£Ø2£©ĖłĮŠŅĒĘ÷ÅŠ¶Ļ£¬Ķź³ÉŹµŃé»¹Č±ÉŁµÄŅĒĘ÷ÓŠŅ©³×”¢___”¢___”£
£Ø4£©ĒėĖµ³ö±¾ŹµŃéÖŠ²£Į§°ōµÄ×÷ÓĆ____________”£
£Ø5£©½«ÉĻĶ¼ÖŠµÄŹµŃé²½ÖčA”«F°“ŹµŃé¹ż³ĢĻČŗó“ĪŠņÅÅĮŠ______________”£
£Ø6£©ĒėÓĆĒ”µ±µÄĪÄ×ÖĆčŹöÉĻĶ¼A²Ł×÷µÄ¹ż³Ģ____________________________”£
£Ø7£©ČōÅäÖĘ¹ż³ĢÖŠ£¬ĘäĖū²Ł×÷¶¼×¼Č·£¬ĻĀĮŠ²Ł×÷ÄÜŅżĘšÅضČĘ«øßµÄÓŠ______(Ģī“śŗÅ)”£
¢ŁÓĆĄ“ČܽāNaOHµÄÉÕ±ĄļĆęÓŠÉŁŠķĖ®
¢ŚĪ“µČĻ”ŹĶŗóµÄNaOHČÜŅŗĄäČ“ÖĮŹŅĪĀ¾Ķ×ŖŅʵ½ČŻĮæĘæÖŠ
¢Ū½«NaOHČÜŅŗ×ŖŅʵ½ČŻĮæĘæŹ±£¬²»Š”ŠÄČöµ½ĮĖĶāĆęÉŁŠķ
¢Ü¶ØČŻŹ±£¬¼ÓÕōĮóĖ®³¬¹ż±źĻߣ¬ÓÖÓĆ½ŗĶ·µĪ¹ÜĪü³ö
¢Ż×ŖŅĘĒ°£¬ČŻĮæĘæÖŠŗ¬ÓŠÉŁĮæÕōĮóĖ®
¢Ž¶ØČŻŅ”ŌČŗ󣬷¢ĻÖŅŗĆęµĶÓŚ±źĻߣ¬ÓÖÓĆ½ŗĶ·µĪ¹Ü¼ÓÕōĮóĖ®ÖĮ±źĻß
¢ß¶ØČŻŹ±£¬ø©ŹÓ±źĻß
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠ¹ŲÓŚÓŠ»śĪļµÄŠšŹö²»ÕżČ·µÄŹĒ£Ø £©
A.ŹÆÓĶŅŗ»ÆĘų”¢ĘūÓĶŗĶŹÆĄÆµÄÖ÷ŅŖ³É·Ö¶¼ŹĒĢ¼Ēā»ÆŗĻĪļ
B.1£¬2-¶žĀČŅŅĶéŌŚNaOH“¼ČÜŅŗÖŠ·¢ÉśĻūČ„·“Ó¦æÉŅŌµĆµ½ŅŅČ²
C.ÓÉCH2=CHCOOCH3ŗĻ³ÉµÄ¾ŪŗĻĪļĪŖ![]()
D.ÄÜÓėNaOHČÜŅŗ·“Ó¦ĒŅ·Ö×ÓŹ½ĪŖC2H4O2µÄÓŠ»śĪļŅ»¶ØŹĒōČĖį
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ“Ó¹ÅÖĮ½ń»ÆѧÓėÉś²ś”¢Éś»īĆÜĒŠĻą¹Ų”£ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ£Ø £©
A.¾§Ģå¹č±»ÓĆÓŚ¼ĘĖ滜Š¾Ę¬£¬¹¤ŅµÖĘ“Ö¹čµÄ·“Ó¦ŌĄķĪŖ£ŗSiO2£«C![]() Si£«CO2”ü
Si£«CO2”ü
B.ŗĻ½šČŪµć”¢Ó²¶Č¶¼µĶÓŚ³É·Ö½šŹō
C.ÖŠ¹śĢģŃŪFASTÓƵ½µÄĢ¼»Æ¹čŹĒŅ»ÖÖŠĀŠĶµÄÓŠ»śøß·Ö×Ó²ÄĮĻ
D.ĪŽÉ«ĶøĆ÷µÄSiO2ŹĒÖĘŌģ¹āµ¼ĻĖĪ¬µÄÖŲŅŖŌĮĻ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŗ£Ė®ÖŠäåŌŖĖŲŅŌBr©ŠĪŹ½“ęŌŚ£¬¹¤ŅµÉĻÓĆæÕĘų“µ³ö·Ø“Óŗ£Ė®ÖŠĢįČ”äåµÄ¹¤ŅÕĮ÷³ĢČēĻĀĶ¼£ŗ

Ēė»Ų“šĻĀĮŠĪŹĢā£®
£Ø1£©½«ŗ£Ė®ÅØĖõµÄ·½·ØŹĒ__£»
£Ø2£©²½Öč¢Ł·“Ó¦µÄĄė×Ó·½³ĢŹ½ŹĒ__£¬1molCl2²Ī¼Ó·“Ó¦£¬×ŖŅʵē×Ó__mol£»
£Ø3£©²½Öč¢ŚĶØČėČČæÕĘų“µ³öBr2£¬ĄūÓĆĮĖBr2µÄ__£ØĢīŠņŗÅ£©£»
A£®Ńõ»ÆŠŌ B£®»¹ŌŠŌ C£®»Ó·¢ŠŌ D£®øÆŹ“ŠŌ
£Ø4£©²½Öč¢ŪÖŠÓĆSO2µÄĖ®ČÜŅŗĪüŹÕBr2£¬ĪüŹÕĀŹæÉ“ļ95%£¬øĆ·“Ó¦µÄŃõ»Æ¼ĮŹĒ__£¬ŌŚ¹¤ŅµÉś²śÖŠ“Ė²½ÖčÓ¦½ā¾öµÄĪŹĢāŹĒ__£®
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æČē±ķĪŖŌŖĖŲÖÜĘŚ±ķµÄŅ»²æ·Ö£¬Ēė²ĪÕÕŌŖĖŲ¢Ł£¢įŌŚ±ķÖŠµÄĪ»ÖĆ£¬ÓĆ»ÆѧÓĆÓļ»Ų“šĻĀĮŠĪŹĢā£ŗ
×å ÖÜĘŚ | ¢ńA | ¢ņA | ¢óA | ¢ōA | ¢õA | ¢öA | ¢÷A | 0 |
1 | ¢Ł | |||||||
2 | ¢Ś | ¢Ū | ¢Ü | |||||
3 | ¢Ż | ¢Ž | ¢ß | ¢ą | ¢į |
£Ø1£©¢Ü”¢¢ŽµÄŌŖĖŲ·ūŗÅ·Ö±šŹĒ_____”¢______
£Ø2£©¢įŌŖĖŲĒā»ÆĪļµÄµē×ÓŹ½ŹĒ________
£Ø3£©¢ąŌŖĖŲµÄŌ×Ó½į¹¹Ź¾ŅāĶ¼ŹĒ__________
£Ø4£©ŌŖĖŲ¢Ł£¢įÖŠŌ×Ó°ė¾¶×ī“óµÄŹĒ_____£»
£Ø6£©ŌŚŹ¢ÓŠĖ®µÄŠ”ÉÕ±ÖŠ¼ÓČėŌŖĖŲ¢ŻµÄµ„ÖŹ£¬·¢Éś·“Ó¦µÄĄė×Ó·½³ĢŹ½ĪŖ______£»ĻņÉĻŹö·“Ó¦ŗóµÄČÜŅŗÖŠ¼ÓČėŌŖĖŲ¢ŽµÄµ„ÖŹ£¬·¢Éś·“Ó¦µÄ»Æѧ·½³ĢŹ½ĪŖ______”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŌŚŹŖ·ØĮ¶ŠæµÄµē½āŃ»·ČÜŅŗÖŠ£¬½ĻøßÅØ¶ČµÄ![]() »įøÆŹ“Ńō¼«°å¶ųŌö“óµē½āÄÜŗÄ”£æÉĻņČÜŅŗÖŠĶ¬Ź±¼ÓČėCuŗĶCuSO4£¬Éś³ÉCuCl³Įµķ“Ó¶ų³żČ„
»įøÆŹ“Ńō¼«°å¶ųŌö“óµē½āÄÜŗÄ”£æÉĻņČÜŅŗÖŠĶ¬Ź±¼ÓČėCuŗĶCuSO4£¬Éś³ÉCuCl³Įµķ“Ó¶ų³żČ„![]() ”£øł¾ŻČÜŅŗÖŠĘ½ŗāŹ±Ļą¹ŲĄė×ÓÅØ¶ČµÄ¹ŲĻµĶ¼£¬ĻĀĮŠĖµ·Ø“ķĪóµÄŹĒ
”£øł¾ŻČÜŅŗÖŠĘ½ŗāŹ±Ļą¹ŲĄė×ÓÅØ¶ČµÄ¹ŲĻµĶ¼£¬ĻĀĮŠĖµ·Ø“ķĪóµÄŹĒ

A. ![]() µÄŹżĮ漶ĪŖ
µÄŹżĮ漶ĪŖ![]()
B. ³ż![]() ·“Ó¦ĪŖCu+Cu2++2
·“Ó¦ĪŖCu+Cu2++2![]() =2CuCl
=2CuCl
C. ¼ÓČėCuŌ½¶ą£¬Cu+ÅضČŌ½øߣ¬³ż![]() Š§¹ūŌ½ŗĆ
Š§¹ūŌ½ŗĆ
D. 2Cu+=Cu2++CuĘ½ŗā³£Źżŗܓ󣬷“Ó¦Ē÷ÓŚĶźČ«
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com