
分析 (1)只有一种物质组成的为纯净物;
(2)依据配制溶液体积选择合适规格容量瓶;依据m=CVM计算需要溶质的质量;
(3)依据配制一定物质的量浓度溶液一般步骤判断解答;
(4)依据容量瓶构造解答;
(5)分析操作对溶质的物质的量或对溶液的体积的影响,根据c=$\frac{n}{V}$分析判断.
解答 解:(1)CuSO4•5H2O只有一种物质组成,属于纯净物;
故答案为:纯净物;
(2)用CuSO4•5H2O晶体配制2mol/L的CuSO4溶液450mL,应选择500mL容量瓶,实际配制500mL溶液,需要溶质的质量m=2mol/L×0.5L×250g/mol=250.0g;
故答案为:②;250g;
(3)配制一定物质的量浓度溶液一般步骤:计算、称量、溶解、冷却、移液、洗涤、定容、摇匀、装瓶贴标签,所以该同学操作不完全,缺少定容操作,定容的正确操作为:向容量瓶中加蒸馏水,加水到接近刻度线1~2厘米时,改用胶头滴管加水至凹液面与刻度线相切;
故答案为:否;向容量瓶中加蒸馏水,加水到接近刻度线1~2厘米时,改用胶头滴管加水至凹液面与刻度线相切;
(4)容量瓶为配制一定物质的量浓度、一定体积的溶液的精密仪器,标有温度、容积、刻度线;
故答案为:温度;
(5)①配制前,容量瓶中有少量蒸馏水,对溶质的物质的量和溶液体积都不会产生影响,溶液浓度物影响,
故答案为:无影响;
②称量时,所用的砝码已生锈,导致秤取的溶质的质量偏大,溶质的物质的量偏大,溶液浓度偏大,
故答案为:偏大;
③转移时,不小心将溶液溅出一些,导致溶质的物质的量偏小,溶液浓度偏小,
故答案为:偏小;
④定容时,俯视溶液的凹液面,导致溶液体积偏小,溶液浓度偏大,
故答案为:偏大.
点评 本题主要考查了一定物质的量浓度的配制步骤、仪器和误差分析,明确配制原理及操作步骤是解题关键,注意误差分析方法.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:填空题
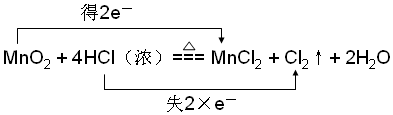 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2SO4→HCl→K2S→NaOH→CO2 | B. | NaCl→Na2SO4→Na2S→NH3•H2O→HCl | ||
| C. | Na2S→Na2SO4→NaCl→NaOH→HCl | D. | NaCl→Na2SO4→H2S→NaOH→CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 相等 | B. | 后者是前者的11倍 | ||
| C. | 后者是前者的108 | D. | 前者是后者的108 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使用催化剂,可加快反应速率,目的是提高生产效率 | |
| B. | 使用冰箱保存食物,是利用了化学反应速率理论 | |
| C. | 化学反应速率理论是研究怎样提高原料转化率 | |
| D. | 化学平衡理论是研究怎样使用有限原料多出产品 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
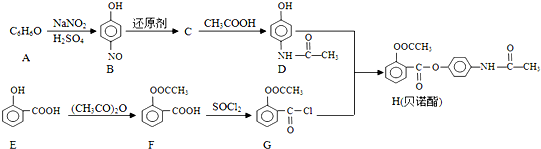
 ;E中含氧官能团的名称为羟基、羧基.
;E中含氧官能团的名称为羟基、羧基. .
.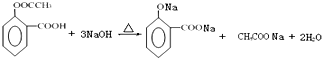 .
.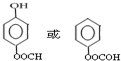 .
.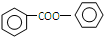 的合成路线流程图(无机试剂可任选):
的合成路线流程图(无机试剂可任选):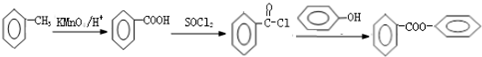 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
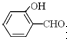 形成分子内氢键,而
形成分子内氢键,而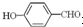 形成分子间氢键,分子间氢键使分子间作用力增大.
形成分子间氢键,分子间氢键使分子间作用力增大.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
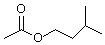 )是组成蜜蜂信息素的成分之一,具有香蕉的香味,实验室制备乙酸异戊酯的反应装置示意图(有关的加热和夹持仪器略去)和有关数据如下:
)是组成蜜蜂信息素的成分之一,具有香蕉的香味,实验室制备乙酸异戊酯的反应装置示意图(有关的加热和夹持仪器略去)和有关数据如下:| 相对分子质量 | 密度/(g•cm-3) | 沸点/℃ | 水中溶解性 | |
| 异戊醇 | 88 | 0.8123 | 131 | 微溶 |
| 乙酸 | 60 | 1.0492 | 118 | 溶 |
| 乙酸异戊酯 | 130 | 0.8670 | 142 | 难溶 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com