
 O2��g��=CO��g��
O2��g��=CO��g��  H1=��110.5 kJ��mol
H1=��110.5 kJ��mol H2=��483.6 kJ��mol
H2=��483.6 kJ��mol H3��
H3�� H3= kJ��mol
H3= kJ��mol



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��

| A����H1����H2����H3����H4 | B����H1����H2����H3����H4 |
| C����H1����H2����H3����H4 | D����H1����H2����H3����H4 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ�ʵ����

| ʵ����� | ��ʼ�¶�t1/�� | ��ֹ�¶�t2/�� | |
| ���� | NaOH��Һ | ||
| 1 | 20.2 | 20.3 | 23.7 |
| 2 | 20.3 | 20.5 | 23.8 |
| 3 | 21.5 | 21.6 | 24.9 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��S��ȼ����Ϊ297��23kJ��mo1 |
| B��S(g)+O2(g)===SO2(g)�ų�����������297��23kJ |
| C��S(g)+O2(g)==SO2(g)�ų�������С��297��23kJ |
| D���γ�1mol SO2(g)�Ļ�ѧ�����ͷŵ����������ڶ���1molS(s)��lmolO2(g)�Ļ�ѧ�������յ������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
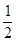 O2(g) �ġ�HΪ
O2(g) �ġ�HΪ| A����484kJ/mol | B��+484kJ/mol | C����242kJ/mol | D��+242kJ/mol |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��H2(g)��Cl2(g)="2HCl(g)" ��H����183 kJ/mol |
| B��1/2H2(g)��1/2Cl2(g)="HCl(g)" ��H����124kJ/mol |
| C��2HCl(g)=H2(g)��Cl2(g) ��H����248 kJ/mol |
| D��HCl(g) =1/2H2(g)��1/2Cl2(g) ��H����91.5 kJ/mol |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��920 kJ | B��557 kJ | C��436 kJ | D��188 kJ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��Q1+Q2+Q3 | B��0.5(Q1+Q2+Q3) | C��0.5Q1��1.5Q2+0.5Q3 | D��1.5Q1��0.5Q2+0.5Q3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��a > b | B��a = b | C��a < b | D����ȷ�� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com