
| 0℃ | 10℃ | 20℃ | 30℃ | 40℃ | 50℃ | 60℃ | 100℃ | |
| NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 | 39.8 |
| NH4HCO3 | 11.9 | 15.8 | 21.0 | 27.0 | - | - | - | - |
| NaHCO3 | 6.9 | 8.1 | 9.6 | 11.1 | 12.7 | 14.5 | 16.4 | - |
| NH4Cl | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 | 55.3 | 77.3 |
分析 (1)要控制恒温,一般用水浴加热;
(2)分析溶解度数据,对比各物质的溶解度,根据溶解度越小越容易析出来分析;
(3)根据溶解平衡的知识分析剩余物的成分;
(4)根据溶解平衡知识进行分析;根据实验目的进行分析转换为氯化钠和氯化铵的所需试剂.
解答 解:(1)温度太低反应速率太慢,所以温度必须控制在一个合理范围内,使温度保持一个恒定,因为控制的温度在100℃以下,所以常用水浴加热来控制.
故答案为:水浴加热;
(2)因为反应不是瞬间完成的,所以要保持一段时间,以使反应充分;故答案为:使反应充分进行;
(3)由溶解度表可看出在30℃~35℃之间,碳酸氢钠的溶解度最小,所以析出的只能是碳酸氢钠;故答案为:NaHCO3的溶解度最小;
(4)根据溶解平衡原理可知,析出碳酸氢钠后的溶液为碳酸氢钠的饱和溶液,所以母液中有未反应完的氯化钠和碳酸氢氨,及生成的氯化铵和没有析出的碳酸氢钠.
为使氯化钠循环使用,可使碳酸氢钠和盐酸反应转换为氯化钠;同时碳酸氢氨和盐酸反应也转换为氯化铵.
故答案为:NaCl.
点评 本题有一定难度,主要考查了学生运用溶解度有关知识分析解决纯碱制取过程中有关问题.


 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案科目:高中化学 来源: 题型:解答题
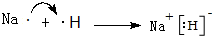 .
.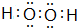
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2、SO2、CO2三种气体都可用浓硫酸干燥 | |
| B. | Fe(OH)3胶体为无色、透明,能发生丁达尔现象 | |
| C. | 在酒精灯加热条件下,Na2CO3、NaHCO3固体都能发生分解 | |
| D. | SiO2既能和氢氟酸反应又能和氢氧化钠溶液反应,所以是两性氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 为探究生活中两种常见的有机物的性质,某同学设计如下实验,请根据题目要求回答下列问题:
为探究生活中两种常见的有机物的性质,某同学设计如下实验,请根据题目要求回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 配制一定物质的量浓度的硫酸溶液时,定容时俯视会造成溶液浓度偏高 | |
| B. | 量取15.20mL AgNO3溶液可以用酸式滴定管 | |
| C. | 过滤完毕,洗涤沉淀时应该向漏斗中加水至没过沉淀,用玻璃棒搅拌充分洗剂,重复2~3次 | |
| D. | 蒸发浓缩CuSO4溶液时,要用玻璃棒搅拌防止溶液溅出 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
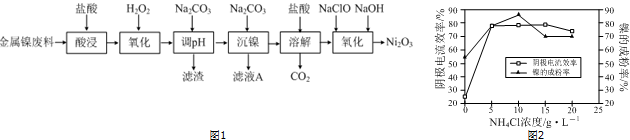
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 | Ni(OH)2 |
| 开始沉淀的pH | 1.1 | 6.5 | 3.5 | 7.1 |
| 沉淀完全的pH | 3.2 | 9.7 | 4.7 | 9.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 催化剂组成 | 1 | 2 | 3 |
| WO3 W α-Fe2O3 | 65% 5% 30% | 65% 10% 25% | a b 20% |
| 六价铬去除率 | 60.2% | 80% | 72.9% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 苯甲酸 | 乙醇 | 苯甲酸乙酯 | |
| 熔点/℃ | 122.4 | -114.1 | -34.6 |
| 沸点/℃ | 249 | 78.3 | 212.6 |
| 密度/g•cm-3 | 1.2659 | 0.816 | 1.05 |
| 水溶性 | 微溶 | 互溶 | 不溶 |
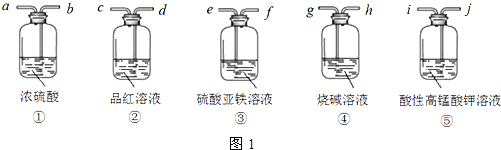
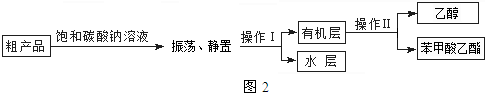
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com