
已知:2CH3OH(g) CH3OCH3(g)+H2O(g);ΔH=-25 kJ·mol-1,某温度下的平衡常数为400。此温度下,在1 L的密闭容器中加入CH3OH,反应到某时刻测得各组分的物质的量浓度如下表,下列说法正确的是 ( )
CH3OCH3(g)+H2O(g);ΔH=-25 kJ·mol-1,某温度下的平衡常数为400。此温度下,在1 L的密闭容器中加入CH3OH,反应到某时刻测得各组分的物质的量浓度如下表,下列说法正确的是 ( )
| 物质 | CH3OH | CH3OCH3 | H2O |
| c/(mol·L-1) | 0.8 | 1.24 | 1.24 |
A. 平衡后升高温度,平衡常数>400
B. 平衡时,c(CH3OCH3)=1.6 mol·L-1
C. 平衡时,反应混合物的总能量减少40 kJ
D. 平衡时,再加入与起始等量的CH3OH,达新平衡后CH3OH转化率增大
 字词句段篇系列答案
字词句段篇系列答案科目:高中化学 来源: 题型:
二氧化氯(ClO2)是目前国际上公认的第四代高效、
无毒的消毒剂,是一种黄绿色的气体,易溶于水。
Ⅰ.(1) ClO2可由KClO3在H2SO4存在的条件下与Na2SO3反应制得。则该反应的氧化产物与还原产物的物质的量之比是________。
Ⅱ.实验室也可用NH4Cl、盐酸、NaClO2(亚氯酸钠)为原料制备ClO2,其流程如下:
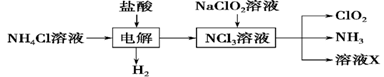
(2) 写出电解时发生反应的化学方程式:____________。
(3) 除去ClO2中的NH3可选用的试剂是________。(填序号)
A.饱和食盐水 B.碱石灰
C.浓硫酸 D.水
(4) 测定ClO2(如右图)的过程如下:在锥形瓶中加入足量的碘化钾,用100 mL水溶解后,
再加3 mL硫酸溶液;在玻璃液封管中加入水;将生成的ClO2气体通过导管在锥形瓶中被吸收;将玻璃封管中的水封液倒入锥形瓶中,加入几滴淀粉溶液,用c mol·L-1硫代硫酸钠标准溶液滴定(I2+2S2O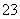 = 2I-+S4O
= 2I-+S4O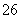 ),共用去V mL硫代硫酸钠溶液。
),共用去V mL硫代硫酸钠溶液。
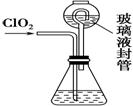
①装置中玻璃液封管的作用是_______________________________________。
②请写出上述二氧化氯气体与碘化钾溶液反应的离子方程式__________________。
③滴定终点的现象是________________________________________________。
④测得通入ClO2的质量m(ClO2)=________。(用含c、V的代数式表示)
(5) 用ClO2处理过的饮用水(pH为5.5~6.5)常含有一定量对人体不利的亚氯酸根离子ClO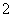
2001年我国卫生部规定,饮用水的ClO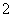 含量应不超过0.2 mg·L-1。若饮用水中ClO
含量应不超过0.2 mg·L-1。若饮用水中ClO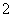 的含量超标,可向其中加入适量的Fe2+,该反应的氧化产物是____________ (填化学式),其发生反应的离子方程式为_________________ __________。
的含量超标,可向其中加入适量的Fe2+,该反应的氧化产物是____________ (填化学式),其发生反应的离子方程式为_________________ __________。
查看答案和解析>>
科目:高中化学 来源: 题型:
普通玻璃、钢铁和玻璃钢是三种不同的材料,它们在性能方面差别很大。请根据学过的知识,回答下面问题。
(1)普通玻璃的成分是____________________________________________。
(2)铁在人类的生产和生活中有着十分重要的应用。铁的应用,经历了________到________到________的演变过程。
(3)某种复合材料具有耐高温、强度高、导电性好、导热性好的特点,估计该复合材料的基体和增强体材料可能分别是( )
A.金属;碳纤维 B.陶瓷;SiO2
C.合成树脂;SiO2、Al2O3、MgO D.合成树脂;碳纤维
查看答案和解析>>
科目:高中化学 来源: 题型:
下列化学实验事实及解释都正确的是 ( )
A.用滴有少量硫酸铜溶液的稀硫酸跟锌粒反应快速地制氢气,说明Cu2+具有催化能力
B.升高温度会加快化学反应速率,其原因是增加了单位体积内活化分子的百分数
C.等体积、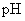 都为3的酸HA和HB分别与足量的锌反应,HA放出的氢气多,说
都为3的酸HA和HB分别与足量的锌反应,HA放出的氢气多,说
明酸性: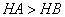
D.向浓度均为0.1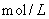 的MgCl2、CuCl2混合溶液中逐滴加入少量氨水,先生成
的MgCl2、CuCl2混合溶液中逐滴加入少量氨水,先生成
Cu(OH)2沉淀,说明Ksp[Cu(OH)2]>Ksp[Mg(OH)2]。
查看答案和解析>>
科目:高中化学 来源: 题型:
化工生产中常用MnS作沉淀剂除去工业废水中的Cu2+:
Cu2+(aq)+MnS(s)  CuS(s)+Mn2+(aq),下列说法错误的是( )
CuS(s)+Mn2+(aq),下列说法错误的是( )
A.MnS的Ksp比CuS的Ksp大
B.该反应达到平衡时:c(Mn2+)/c(Cu2+) =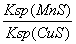
C.往平衡体系中加入少量CuSO4固体后,c(Mn2+)变大
D.MnS(s)的浊液中加入少量可溶性MnSO4固体后, c(S2-)变大
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)常温下将0.2mol/L HCl溶液与0.2mol/L MOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=6,试回答以下问题:
①混合溶液中由水电离出的c(H+) 0.2mol/LHCl溶液中由水电离出的c(H+);
(填“>”、“<”、或“=”)
②求出混合溶液中下列算式的精确计算结果(填具体数字):
c(Cl-)-c(M+)= mol/L。
(2)常温下若将0.2mol/L MOH溶液与0.1mol/L HCl溶液等体积混合,测得混合溶液的pH<7,则说明在相同条件下MOH的电离程度 MCl的水解程度。
(填“>”、“<”、或“=”)
(3)常温下若将pH=3的HR溶液与pH=11的NaOH溶液等体积混合,测得混合溶液的pH≠7,则混合溶液的pH 。(填“>7”、“<7”、或“无法确定”)
(4)用0.1032mol/L HCl溶液滴定未知浓度的NaOH溶液,重复三次的实验数据如下所示
| 实验序号 | 0.1032mol/L HCl溶液体积/mL | 待测NaOH溶液体积/mL |
| 1 | 27.83 | 25.00 |
| 2 | 25.53 | 25.00 |
| 3 | 27.85 | 25.00 |
①待测NaOH溶液的物质的量浓度为 mol/L。(保留四位有效数字)
②下列情况可能引起测定结果偏高的是 。
A.酸式滴定管未用标准盐酸溶液润洗
B.锥形瓶未用待测液润洗
C.滴定前滴定管尖嘴中有一气泡,滴定后气泡消失了
D.滴定前,滴定管中的溶液液面最低点在“0”点以下
(5)滴定的方法有酸碱中和滴定、沉淀滴定、络合滴定等。沉淀滴定所用的指示剂本身就是一种沉淀剂。已知一些银盐的颜色和Ksp(20℃)如下,测定水体中氯化物的含量,常用标准硝酸银溶液进行滴定。
| 化学式 | AgCl | AgBr | AgI | Ag2S | Ag2CrO4 |
| 颜色 | 白色 | 浅黄色 | 黄色 | 黑色 | 红色 |
| Ksp | 1.8×10-10 | 5.0×10-13 | 8.3×10-17 | 2.0×10-48 | 1.8×10-10 |
滴定时,你认为该滴定适宜选用的指示剂是下列中的 。
A. KBr B. KI C. K2S D. K2CrO4
查看答案和解析>>
科目:高中化学 来源: 题型:
配制一定物质的量浓度的NaOH溶液时,造成所配溶液浓度偏低的原因是( )
A.定容时俯视液面 B.转移溶液前溶液未冷却至室温
C.容量瓶未干燥 D.未洗涤烧杯和玻璃棒
查看答案和解析>>
科目:高中化学 来源: 题型:
甲、乙两种溶液中分别含有大量的Cu2+、K+、H+、Cl-、CO 、OH-这6种离子中的3种(两种溶液中的离子不重复),已知甲溶液呈蓝色,则乙溶液中大量存在的离子是( )
、OH-这6种离子中的3种(两种溶液中的离子不重复),已知甲溶液呈蓝色,则乙溶液中大量存在的离子是( )
A.K+、OH-、CO B. Cu2+、H+、Cl-
B. Cu2+、H+、Cl-
C.K+、H+、Cl- D. CO 、OH-、Cl-
、OH-、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
下列根据实验现象所得出的结论不正确的是( )
A.无色溶液使紫色石蕊试液变蓝;结论:溶液一定呈碱性
B.无色溶液焰色反应呈紫色(透过蓝色钴玻璃观察),结论:溶液中一定含有K+
C.在无色溶液中加入Na2CO3溶液产生白色沉淀;结论:溶液中一定含有Ca2+
D.在无色盐溶液中加入NaOH溶液,加热产生的气体使湿润的红色石蕊试纸变蓝;结论:溶液一定含有NH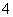
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com