
A.FeCl3溶液中加入铁粉:Fe+Fe3+![]() 2Fe2+
2Fe2+
B.NH4HSO4溶液中加入少量NaOH:+OH-![]() NH3·H2O
NH3·H2O
C.饱和石灰水与饱和CaCl2溶液混合:Ca2++2OH-![]() Ca(OH)2↓
Ca(OH)2↓
D.氯气通入Na2SO3溶液中:Cl2+![]() +H2O
+H2O![]()
![]() +2HCl
+2HCl
 应用题作业本系列答案
应用题作业本系列答案 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案科目:高中化学 来源: 题型:
| ||
| ||
| 5 |
| 2 |
| 5 |
| 2 |
查看答案和解析>>
科目:高中化学 来源:2012-2013年江苏南京学大教育专修学校高二9月月测理科化学试卷(带解析) 题型:填空题
(12分)某同学对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”、“纸漏斗的下部被烧穿,有熔融物落入沙中”。查阅《化学手册》知,Al、Al2O3、Fe、Fe2O3熔点、沸点数据如下:
| 物质 | Al | Al2O3 | Fe | Fe2O3 |
| 熔点/℃ | 660 | 2054 | 1535 | 1462 |
| 沸点/℃ | 2467 | 2980 | 2750 | -- |
查看答案和解析>>
科目:高中化学 来源:2014届江苏南京学大教育专修学校高二9月月测理科化学试卷(解析版) 题型:填空题
(12分)某同学对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”、“纸漏斗的下部被烧穿,有熔融物落入沙中”。查阅《化学手册》知,Al、Al2O3、Fe、Fe2O3熔点、沸点数据如下:
|
物质 |
Al |
Al2O3 |
Fe |
Fe2O3 |
|
熔点/℃ |
660 |
2054 |
1535 |
1462 |
|
沸点/℃ |
2467 |
2980 |
2750 |
-- |
I.该同学推测,铝热反应所得到的熔融物应是铁铝合金。理由是:该反应放出的热量使铁熔化,而铝的熔点比铁低,此时液态的铁和铝熔合形成铁铝合金。请你设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝。该实验所用试剂是 ,反应的离子方程式为 。
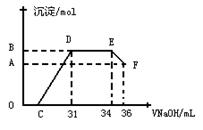
Ⅱ. 实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低。某同学取一定量上述的熔融物与一定量很稀的硝酸充分反应,反应过程中无气体放出。在反应结束后的溶液中,逐滴加入4mol·L-1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示。试回答下列问题:
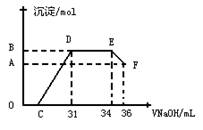
(1)图中OC段没有沉淀生成,此阶段发生反应的离子为: 。
(2)在DE段,沉淀的物质的量没有变化,则此阶段发生反应的离子方为 。
(3)当c=13mL时,原溶液中Fe3+与Al3+的物质的量之比为 。
查看答案和解析>>
科目:高中化学 来源:2010年黑龙江省高三上学期期中考试(化学) 题型:填空题
(8分)A、B、C、D、E都是短周期元素,原子序数依次增大,A、B处于同一周期,C、D、E同处另一周期。C、B可按原子个数比2∶l和1∶1分别形成两种离子化合物甲和乙。A原子的最外层电子数比次外层电子层多3个。E是地壳中含量最高的金属元素。
根据以上信息回答下列问题:
(1)D元素在周期表中的位置是 ,A的最高价氧化物的化学式
是 。
(2)A、B、C、D、E五种元素的原子半径由小到大的顺序是(用元素符号填写) 。
(3)E的最高价氧化物对应的水化物与C的最高价氧化物对应的水化物发生反应的化学方
程式是 。
(4)简述比较D与E金属性强弱的实验方法; 。
查看答案和解析>>
科目:高中化学 来源:2010年宁夏青铜峡市高一下学期期末考试化学试题 题型:填空题
(8分)A、B、C、D、E都是短周期元素,原子序数依次增大,A、B处于同一周期,C、D、E同处另一周期。C、B可按原子个数比2∶l和1∶1分别形成两种离子化合物甲和乙。A原子的最外层电子数比次外层电子层多3个。E是地壳中含量最高的金属元素。
根据以上信息回答下列问题:
(1)D元素在周期表中的位置是 ,A的最高价氧化物的化学式
是 。
(2)A、B、C、D、E五种元素的原子半径由小到大的顺序是(用元素符号填写) 。
(3)E的最高价氧化物对应的水化物与C的最高价氧化物对应的水化物发生反应的化学方
程式是 。
(4)简述比较D与E金属性强弱的实验方法; 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com