

| ||
| ||


科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
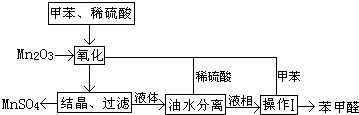
| 反应时间/h | 1 | 2 | 3 | 4 | 5 |
| 苯甲醛产率/% | 76.0 | 87.5 | 83.6 | 72.5 | 64.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:
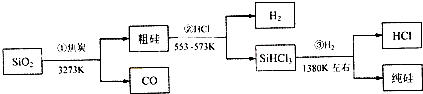
| A、①②③均属于氧化还原反应 |
| B、H2和HCl均可循环利用 |
| C、SiO2是一种坚硬难熔的固体 |
| D、光纤的主要成分是高纯度的单质硅 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、X和Y两种元素构成一种阴离子,该阴离子与强酸反应时,可能变成Y的阳离子 |
| B、元素Y的最高价氧化物能溶于Z的最高价氧化物的水化物中 |
| C、X、Y和Z三元素组成的化合物为碱 |
| D、X与Z的单质在不同条件下能生成不同的化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:


| SOCl2 |
| R′OH |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 物质 | 颜色、性质 | 物质 | 颜色、性质 | |
| 氢氧化铜Cu(OH)2 | 蓝色固体不溶于水 | 硫酸铜(CuSO4) | 溶液呈蓝色 | |
| 氧化亚铜(Cu2O) | 红色固体不溶于水 | 氯化铜(CuCl2) | 溶液绿色,稀溶液蓝色 | |
| 氯化亚铜(CuCl) | 白色固体不溶于水 | 碱式氯化铜 | 绿色固体不溶于水 |
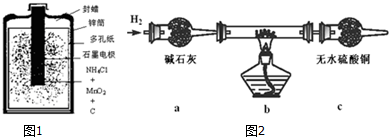
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com