
分析 (1)如生成沉淀,应满足c(Cu2+)×c2(OH-)>2×10-20,c(Cu2+)=0.02mol/L,可计算c(OH-),进而计算pH;
(2)使0.2mol•L-1 CuSO4溶液中Cu2+沉淀较为完全(使Cu2+浓度降至原来的千分之一),则c(Cu2+)=2×10-5mol/L,以此计算pH.
解答 解:(1)如生成沉淀,应满足c(Cu2+)×c2(OH-)>2×10-20,c(Cu2+)=0.02mol/L,则c(OH-)=$\sqrt{\frac{2×1{0}^{-20}}{0.02}}$mol/L=10-9mol/L,则c(H+)=10-5mol/L,pH=5,
故答案为:5;
(2)使0.2mol•L-1 CuSO4溶液中Cu2+沉淀较为完全(使Cu2+浓度降至原来的千分之一),则c(Cu2+)=2×10-4mol/L,则c(OH-)=$\sqrt{\frac{2×1{0}^{-20}}{2×1{0}^{-4}}}$mol/L=10-6mol/L,则c(H+)=10-6mol/L,pH=6,故答案为:6.
点评 本题考查溶度积常数的计算,为高频考点,侧重于学生的分析能力和计算能力的考查,题目难度不大,注意把握计算公式的运用.


 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案科目:高中化学 来源: 题型:推断题
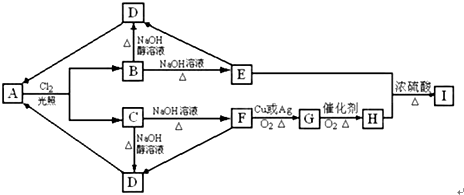
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | Na+、Ag+、Cl-、CO32- | B. | H+、Na+、Fe2+、MnO4- | ||
| C. | K+、Ca2+、Cl-、NO3- | D. | K+、NH4+、OH-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCl、CO2、CO | B. | CO、H2、H2O | C. | HCl、CO2、H2 | D. | HCl、CO2、H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ⑤①②③④⑥⑦ | B. | ③⑤①②⑥⑦④ | C. | ③⑤②⑦①⑥④ | D. | ②⑥⑦①③⑤④ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
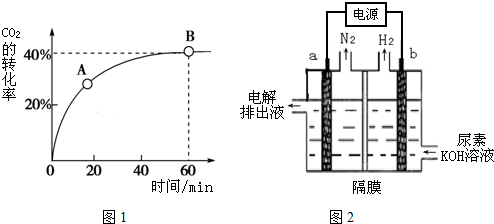
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
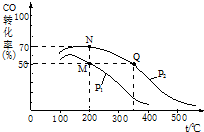 “洁净煤技术”研究在世界上相当普遍.
“洁净煤技术”研究在世界上相当普遍.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 物质的溶解性为难溶,则该物质的溶解度为0 | |
| B. | 某离子被沉淀完全是指该离子在溶液中的浓度为0 | |
| C. | 通过沉淀反应能将大部分杂质离子沉淀 | |
| D. | 难溶电解质的溶度积越小,溶解度越大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com