
10ml浓度为1mol/L的盐酸与过量的锌粉反应,若加入适量的下列溶液,能减慢反应速率但又不影响氢气生成的是( )
A.K2SO4 B.CH3COONa C.CuSO4 D.Na2CO3
【答案】A、B
【解析】Zn与稀盐酸发生反应:Zn+2HCl=ZnCl2+H2↑,若加入物质是反应速率降低,则c(H+)减小。但是不影响产生氢气的物质的量,说明最终电离产生的n(H+)不变。A、K2SO4是强酸强碱盐,不发生水解,溶液显中性,溶液中的水对盐酸起稀释作用,使c(H+)减小,但没有消耗H+,因此n(H+)不变,符合题意,正确;B、CH3COONa与HCl发生反应:CH3COONa+HCl=CH3COOH+NaCl,使溶液中c(H+)减小,反应速率降低,当反应进行到一定程度,会发生反应:2CH3COOH+Zn= (CH3COO)2Zn+ H2↑,因此最终不会影响产生氢气的物质的量,正确;C、加入CuSO4溶液会与Zn发生置换反应:CuSO4+Zn=Cu+ZnSO4,产生的Cu与Zn和盐酸构成原电池。会加快反应速率,与题意不符合,错误;D、若加入Na2CO3溶液,会与盐酸发生反应:Na2CO3+2HCl=2Na Cl2+H2O+CO2↑,使溶液中溶液中的c(H+)减小,但由于逸出了CO2气体,因此使n(H+)也减小,产生氢气的物质的量减小,不符合题意,错误。
Cl2+H2O+CO2↑,使溶液中溶液中的c(H+)减小,但由于逸出了CO2气体,因此使n(H+)也减小,产生氢气的物质的量减小,不符合题意,错误。
【考点定位】考查影响化学反应速率速率的因素。
【名师点睛】本题将外界条件对化学反应速率速率的影响因素与物质之间的反应、弱电解质的电离和原电池原理的应用结合在一起考查浓度为化学反应速率的影响、原电池反应能加快化学反应速率,考查学生分析问题、解决问题的能力。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
核糖是合成核酸的重要原料,其结构简式为CH2OH—CHOH—CHOH—CHOH—CHO。下列关于核糖的叙述正确的是( )
A.与葡萄糖互为同分异构体
B.可以与银氨溶液作用形成银镜
C.可发生水解反应
D.可以使紫色石蕊试液变红
查看答案和解析>>
科目:高中化学 来源: 题型:
硅、硫、钠、铁、铝、铜等元素及其化合物在日常生活和生产中应用广泛,回答下列问题:
(1)Si元素在周期表中的位置是 , Na2S的电子式为 。
(2)H2S 、H2O 、SiO2、Na2O熔沸点由高到低的顺序为 。(用化学式表示)
(3)工业上常用氯化铁溶液腐蚀铜制电路板,反应的离子方程式是 。
要从上述腐蚀液中获得较纯的CuCl2溶液,需要将杂质 FeCl3和FeCl2除去,首先将Fe2+氧化成Fe3+,再向溶液中加入 (填化学式),最后过滤。
(4)在CuSO4溶液中通入过量的NH3,小心蒸发,最终得到[ Cu(NH3)4]SO4 晶体,晶体中含有的化学键除普通的共价键外,还含有 。
(5)将4.6g Na和8.1gAl组成的混合物投入到足量的水中,生成H2在标准状况下的体积为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
室温下,向下列溶液中通入相应的气体至溶液pH=7(通入气体对溶液体积的影响可忽略),溶液中部分微粒的物质的量浓度关系正确的是( )
A.向0.10mol·L-1NH4HCO3溶液中通入CO2:c(NH4+)=c(HCO3-)+c(CO32-)
B.向0.10mol·L-1NaHSO3溶液中通入NH3:c(Na+)>c(NH4+)>c(SO32-)
C.0.10mol·L-1Na2SO3溶液通入SO2:c(Na+)=2[c(SO32-)+c(HSO3-)+c(H2SO3)]
D.0.10mol·L-1CH3COONa溶液中通入HCl:c(Na+)>c(CH3COOH)=c(Cl-)
查看答案和解析>>
科目:高中化学 来源: 题型:
羰基硫(COS)可作为一种粮食熏蒸剂,能防止某些昆虫、线虫和真菌的危害。在恒容密闭容器中,将CO和H2S混合加热并达到下列平衡: CO(g)+H2S(g) COS(g)+H2(g) K=0.1
COS(g)+H2(g) K=0.1
反应前CO物质的量为10mol,平衡后CO物质的量为8mol。下列说法正确的是( )
A.升高温度,H2S浓度增加,表明该反应是吸热反应
B.通入CO后,正反应速率逐渐增大
C.反应前H2S物质的量为7mol
D.CO的平衡转化率为80%
查看答案和解析>>
科目:高中化学 来源: 题型:
氢能是一种极具发展潜力的清洁能源。以太阳能为热源,热化学硫碘循环分解水是一种高效、无污染的制氢方法。其反应过程如下图所示:
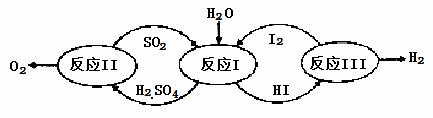
(1)反应Ⅰ的化学方程式是 。
(2)反应Ⅰ得到的产物用I2进行分离。该产物的溶液在过量I2的存在下会分成两层——含低浓度I2的H2SO4层和高浓度的I2的HI层。
①根据上述事实,下列说法正确的是 (选填序号)。
a.两层溶液的密度存在差异
b.加I2前,H2SO4溶液和HI溶液不互溶
c.I2在HI溶液中比在H2SO4溶液中易溶
②辨别两层溶液的方法是 。
③经检测,H2SO4层中c(H+):c(SO42-)=2.06:1。其比值大于2的原因是 。
(3)反应Ⅱ:2H2SO4(l)=2SO2(g)+O2(g)+2H2O(g) △H=+550kJ/mol
它由两步反应组成:i.H2SO4(l)=SO3(g) +H2O(g) △H=+177kJ/mol
ii.SO3(g)分解。
L(L1、L2),X可分别代表压强或温度。下图表示L一定时,ii中SO3(g)的平衡转化率随X的变化关系。
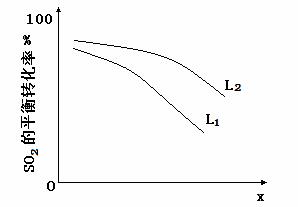
①X代表的物理量是 。
②判断L1、L2的大小关系,并简述理由: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
乙苯催化脱氢制苯乙烯反应:
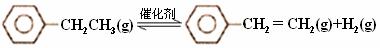
(1)已知:
| 化学键 | C-H | C-C | C=C | H-H |
| 键能/kJ·molˉ1 | 412 | 348 | 612 | 436 |
计算上述反应的△H=________ kJ·mol-1。
(2)维持体系总压强p恒定,在温度T时,物质的量为n、体积为V的乙苯蒸汽发生催化脱氢反应。已知乙苯的平衡转化率为α,则在该温度下反应的平衡常数K=____________ (用α等符号表示)。
(3)工业上,通常在乙苯蒸气中掺混水蒸气 (原料气中乙苯和水蒸气的物质的量之比为1︰9),控制反应温度600℃,并保持体系总压为常压的条件下进行反应。在不同反应温度下,乙苯的平衡转化率和某催化剂作用下苯乙烯的选择性(指除了H2以外的产物中苯乙烯的物质的量分数)示意图如下:
(原料气中乙苯和水蒸气的物质的量之比为1︰9),控制反应温度600℃,并保持体系总压为常压的条件下进行反应。在不同反应温度下,乙苯的平衡转化率和某催化剂作用下苯乙烯的选择性(指除了H2以外的产物中苯乙烯的物质的量分数)示意图如下:
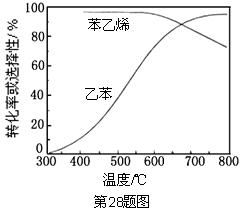
①掺入水蒸气能提高乙苯的平衡转化率,解释说明该事实___________。
②控制反应温度为600℃的理由是____________。
(4)某研究机构用CO2代替水蒸气开发了绿色化学合成工艺——乙苯-二氧化碳耦合催化脱氢制苯乙烯。保持常压和原料气比例不变,与掺水蒸汽工艺相比,在相同的生产效率下,可降低操作温度;该工艺中还能够发生反应:CO2+H2=CO+H2O,CO2+C=2CO。新工艺的特点有_________(填编号)。
① CO2与H2反应,使乙苯脱氢反应的化学平衡右移
② 不用高温水蒸气,可降低能量消耗
③ 有利于减少积炭
④ 有利于CO2资源利用
查看答案和解析>>
科目:高中化学 来源: 题型:
下列反应中,调节反应物用量或浓度,或改变反应的温度,不会改变反应产物的是()
①Na与氧气反应②乙醇和浓硫酸共热③二氧化硫通入烧碱溶液 ④硫酸中加入铁粉⑤氨水加入硝酸银溶液 ⑥铁与硝酸溶液 ⑦硫化氢在氧气中燃烧⑧金属钠投入水中.
| A. | ②④⑤ | B. | ①③⑥ | C. | ④⑦ | D. | ⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:
合金贮氢材料具有优异的吸收氢性能,在配合氢能的开发中起到重要作用。
(1)一定温度下,某贮氢合金(M)的贮氢过程如图所示,纵轴为平衡时氢气的压强(p),横轴表示固相中氢原子与金属原子的个数比(H/M)。
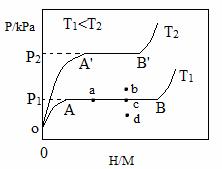
在OA段,氢溶解于M中形成固溶体MHx,随着氢气压强的增大,H/M逐惭增大;在AB段,MHx与氢气发生氢化反应生成氢化物MHy,氢化反应方程式为:zMHx(s)+H2(g)==ZMHy(s) △H(Ⅰ);在B点,氢化反应结束,进一步增大氢气压强,H/M几乎不变。反应(Ⅰ)中z=_____(用含x和y的代数式表示)。温度为T1时,2g某合金4min内吸收氢气240mL,吸氢速率v=______mL•g-1•min。反应的焓变△HⅠ_____0(填“>”“<”或“=”)。
(2)η表示单位质量贮氢合金在氢化反应阶段的最大吸氢量占其总吸氢量的比例,则温度为T1、T2时,η(T1)____η(T2)(填“>”“<”或“=”)。当反应(Ⅰ)处于图中a点时,保持温度不变,向恒容体系中通入少量氢气,达到平衡后反应(Ⅰ)可能处于图中的_____点(填“b”“c”或“d”),该贮氢合金可通过______或_______的方式释放氢气。
(3)贮氢合金ThNi5可催化由CO、H2合成CH4的反应,温度为T时,该反应的热化学方程式为_________。已知温度为T时:CH4(g)+2H2O=CO2(g)+4H2(g) △H=+165KJ•mol
CO(g)+H2O(g)=CO2(g)+H2(g) △H=-41KJ•mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com