
����Ŀ������β���ж�������������Ϳ������������������Ҫ��ɣ�ij������������β��Ϊԭ��̽����������������Ļ�ѧ���ʣ�
��1��I������β�����������ࡢCO��SO2��NO�����ʣ���ұ���ķ���֮һ������������������װһ������ת���������ò����ٺϽ����������������ص���ʹCO��NO��Ӧ�����ɿɲ��������̬����ѭ���������壬����ʹ������ȼ�ռ�SO2��ת����д��һ����̼��һ��������Ӧ�Ļ�ѧ����ʽ�� ������������ɫ������������̽��������Ⱦ��SO2�����ʣ������ͼʵ��װ�ã���ش�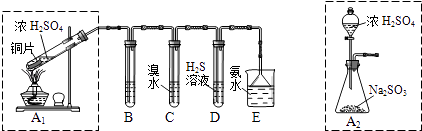
B��C��D�ֱ����ڼ���SO2��Ư���ԡ���ԭ�Ժ������ԣ���B����ʢ�Լ�Ϊ��C�з�Ӧ�����ӷ���ʽΪ ��
��2��Ϊ��ʵ����ɫ������Ŀ�꣬��ȡSO2װ�����ѡ�� �� ��A1��A2װ�ã��ð�ˮ����β���е�SO2 �� ������Һ���п��ܺ���OH����SO32����SO42����HSO3���������ӣ���ش�
��3����ˮ���չ���SO2�ķ�Ӧ�����ӷ���ʽΪ
��4����֪����������һ��������ˮ��SO2Ҳ������ˮ�������������Լ�Ϊ��С�ձ����Թܡ�����������ͷ�ιܡ�����װ�ú���ֽ��2mol/L���ᡢ2mol/LHNO3��1mol/LBaCl2��Һ��l mol/LBa��OH��2��Һ��Ʒ����Һ������ˮ�������ʵ��֤��������Һ���д���SO32����HSO3�� �� ����±���ʵ�������Ԥ������ͽ��ۣ�
ʵ����� | Ԥ����������� |
����1��ȡ����������Һ����С�ձ��У��ý�ͷ�ι�ȡl mol/L BaCl2��Һ��С�ձ��μ�ֱ�������� | �����ְ�ɫ���ǣ�����Һ�д���SO32���� SO42�� �� |
����2����С�ձ��е���Һ���ˡ�ϴ�ӣ���������ˮ�Ѹ�����ֽ�ϵĹ��������һС�ձ��У�����µĹ��� �� |
���𰸡�
��1��2CO+2NO?2CO2+N2��Ʒ����Һ��SO2+Br2+2H2O�TSO42��+2Br��+4H+
��2��A2
��3��NH3?H2O+SO2=NH4++HSO3��
��4������1��Ʒ�죬�ٵ������2 mol/L���ᣬ�����Թ�ȡ������Һ�������е������l mol/LBa��OH��2��Һ����1��Ʒ�죬�ٵ���2��3��2 mol/L���ᣩ������Ʒ����ɫ���������ݣ������SO32���������ְ�ɫ��������Ʒ����ɫ�������ݣ��������HSO3��
���������⣺��1��I��һ����̼��һ�������ڴ����������·�Ӧ���ɶ�����̼�͵���������ʽ��2CO+2NO2CO2+N2 �� ���Դ��ǣ�2CO+2NO2CO2+N2�� II������װ��ͼ��֪��ͭ��Ũ������ȷ�Ӧ���ɶ����������壬B��C��D�ֱ����ڼ���SO2��Ư���ԡ���ԭ�Ժ������ԣ�����C��D�ֱ�Ϊ��ˮ�������ˮ��Һ��C�����������Ļ�ԭ�ԣ�D�����������������ԣ������������Ư���Կ���ͨ��Ʒ����Һ��Ʒ����ɫ�Ƕ���������������ԣ�����������л�ԭ�ԣ��͵ⵥ�ʷ�Ӧ��������͵⻯�⣻��Ӧ�����ַ���ʽΪ��SO2+I2+2H2O�TSO42��+2I��+4H+��
���Դ��ǣ�Ʒ����Һ�� SO2+I2+2H2O�TSO42��+2I��+4H+����2��װ��ͼ������֪��A2����ȡװ��������A1װ�ã����Բ���Ҫ���Ȼ��Լ��Դ��ҩƷ���÷�Һ©������������Կ��Ʒ�Ӧ���ʣ����ڿ��Ʒ�Ӧ���У���Ӧ����֣�
���Դ��ǣ�A2����3����ˮ���չ���SO2�ķ�Ӧ�����ӷ���ʽΪNH3H2O+SO2�TNH4++HSO3����
���Դ��ǣ�NH3H2O+SO2�TNH4++HSO3������4������SO32����HSO3�����ӵ����ʺͼ��鷽�����ʵ����м�����ƣ���������Ϣ��������ȡ������С�ձ��м�������Ȼ�����Ӧ���ɳ���Ϊ�����ᱵ�����ᱵ������ȡ��������������ɶ�������ͨ�������������Ĵ��ڷ�����֤����������ӵĴ��ڣ�ȡ��Һ����������������Ӻ��ᷴӦ�������ɶ�������������������ʵ����ƣ���ͨ��������������Ӻ�����������Ӧ���ɳ��������жϣ�ʵ����Ʒ����Ͳ���Ϊ��
ʵ����� | Ԥ����������� |
����2������1��Ʒ�죬�ٵ������2 mol/L���ᣬ�� | ��Ʒ����ɫ���������ݣ������SO32�� |
����3�����Թ�ȡ������Һ�������е������l mol/LBa��OH��2��Һ����1��Ʒ�죬�ٵ���2��3��2 mol/L���ᣩ���� | �����ְ�ɫ��������Ʒ����ɫ�������ݣ��������HSO3�� |
�� ���Դ��ǣ�
ʵ����� | Ԥ����������� |
����2������1��Ʒ�죬�ٵ������2 mol/L���ᣬ�� | ��Ʒ����ɫ���������ݣ������SO32�� |
����3�����Թ�ȡ������Һ�������е������l mol/LBa��OH��2��Һ����1��Ʒ�죬�ٵ���2��3��2 mol/L���ᣩ���� | �����ְ�ɫ��������Ʒ����ɫ�������ݣ��������HSO3�� |



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵������ȷ����
A. ���ں�ˮ���Ի���̬��ʽ����
B. �Ӻ�ˮ����ȡ��Ҫ����Ũ������������ȡ��������
C. ��ȡ����þ�ǵ���Ȼ�þ������Һ
D. ���ڳ�������Һ̬������ɫ��������ɫ��ͬ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ������ѧϰ��ѧ����Ҫ���ߡ�����������ʾ���ʱ仯�Ļ�ѧ�����У�����ȷ����( )
A. ���ˮ�еμ�FeCl3��Һ�Ʊ�Fe(OH)3���壺Fe3+��3H2O![]() Fe(OH)3�����壩��3H+
Fe(OH)3�����壩��3H+
B. ����ˮ������ӷ���ʽ�� Al3++ 3 H2O![]() Al(OH)3+3H+
Al(OH)3+3H+
C. ��ʯī���缫����Ȼ�����Һ��2Cl����2H2O![]() 2OH����H2����Cl2��
2OH����H2����Cl2��
D. ������ˮ��Һ�еĵ��뷽��ʽ��H2S + H2O![]() HS- + H3O+
HS- + H3O+
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Ԫ��A��B��C��D�����й����ʻ�ṹ��Ϣ�����ʾ��
Ԫ�� | A | B | C | D |
�й����ʻ�ṹ��Ϣ | ���γ�+7�۵Ļ����� | ��̬ԭ�Ӻ���s�ܼ��ϵĵ�������p�ܼ��ϵĵ�������2�� | ��Ԫ���γɵĵ���ͨ��������ͬ�������壬����һ�ֵ��ʷֲ��ڸ߿գ�������ֹ������������ | ͨ����������γɶ����������ȶ���˫ԭ���ӷ��� |
��1��Bλ��Ԫ�����ڱ��е����ڵ��壬Ԫ��B��Ԫ��C��ȣ��縺�Խ�С������дԪ�����ƣ���������BC2������B�ĵ��ʾ���������ͬһ���ͻ�ͬ���ͣ���
��2��д��Ԫ��C�ĺ���10�����ӵ�һ�ֺ��ط��� �� B��һ���⻯��B2H2�����ЦҼ���м�����Ŀ֮��Ϊ ��
��3��C��D������ɶ�����ʽ�Ļ��������D2C5�ܹ�ˮ��Ӧ��������X��д������X��ϡ��Һ�������Fe��Ӧ�����ӷ���ʽ��
��4��A�����{��������Ϊ��ɫҺ�壬9.15g��������������ˮ��ϣ��õ�һ��ϡ��Һ�����ų�QKJ�������÷�Ӧ���Ȼ�ѧ��Ӧ����ʽΪ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ӳ����������Σ���ͼ��ʾ�����ڸߵ�ѹ���������õľ�Ե�ԣ��ڵ�����ҵ�������Ź㷺����;������ɢ�������л���������ЧӦ�������й�����������Ʋ���ȷ���ǣ� �� 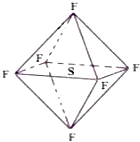
A.����������ȼ�����ɶ�������
B.���������и�ԭ�Ӿ��ﵽ8�����ȶ��ṹ
C.������������е�S��F�����ǦҼ����Ҽ��������ܶ����
D.������������Ǽ��Է���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ�������£����ݻ�Ϊ0.1L���ܱ������У�ͨ��0.4molN2��1.2molH2�����з�Ӧ��2s��ﵽƽ�⣬��ʱ�����ڵ�ѹǿΪ��ʼʱ��3/4���Իش�
��1�����жϸ÷�Ӧ�ﵽƽ��״̬��������___________
A���Ͽ�3molH��H����ͬʱ�Ͽ�2molN��H�� B��c(N2) : c(H2): c(NH3) =1:3:2
C����������ƽ����Է����������� D���������ܶȲ���
��2��N2��ת������1%��_________������ͬ�����£��˷�Ӧ���ݻ��ɱ�������н��У�����ѹǿ���䣬�ﵽƽ�⣬��N2��ת������2%________��1%������>������<������=����
��3�����¶��£���Ӧ�Ļ�ѧƽ�ⳣ��K=__________������ʱ�ټ���0.6molN2��0.4mol NH3����ƽ��_______________�����������ƶ������������ƶ����������ƶ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ɫӫ�⵰�ף�GFP����һ����Է���������С�ĵ��ף��������ˮĸ�з��ֵģ��������ڱ�ǵ��ף����¹���GFP��˵����ȷ���ǣ� ��
A.�������л��߷��ӻ�����
B.��ȩ��ʹ�����
C.��ǿ�ᡢǿ���Ӧ
D.���ܷ���ˮ�ⷴӦ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��Һ�п��ܺ���OH�� �� CO32�� �� AlO2�� �� SiO32�� �� SO42�� �� Na+ �� Fe3+ �� Mg2+ �� Al3+�����ӣ�������Һ����μ���һ�����ʵ���������ʱ�����ɳ������ʵ����������������Ĺ�ϵ��ͼ��ʾ�������ж���ȷ���ǣ� �� 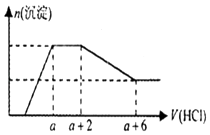
A.ԭ��Һ��һ������Na2SO4
B.��Ӧ���γɵ���Һ����ΪNaCl
C.ԭ��Һ�к���CO32����AlO2�������ʵ�����Ϊ1��1
D.ԭ��Һ��һ�����е�������OH�� �� CO32�� �� SiO32�� �� AlO2��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com