
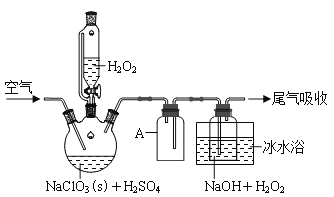
����Ŀ��ClO2��һ����������������Ũ�ȹ���ʱ�����ֽ⣬�������Ʊ���NaClO2�����Ա���������档�������ⷨ�Ʊ�NaClO2�����ʵ��װ����ͼ1��ʾ��
��֪��2NaClO2+H2O2+H2SO4=2ClO2��+O2��+Na2SO4+2H2O
2ClO2+H2O2+2NaOH=2NaClO2+O2��+2H2O
ClO2�۵�-59�桢�е�11�棻H2O2�е�150��
��ش�
������A��������_____����ˮԡ��ȴ��Ŀ����_____(д������)��
�ƿ������ٹ���������������NaClO2���ʣ��Խ�����ԭ��______��
(3)Cl-����ʱ���ClO2�����ɡ���Ӧ��ʼʱ��������ƿ�м����������ᣬClO2���������ʴ����ߣ����������������ù��̿��ܾ�������Ӧ��ɣ����䲹����������_____(�����ӷ���ʽ��ʾ)����H2O2+Cl2=2Cl-+O2+2H+��
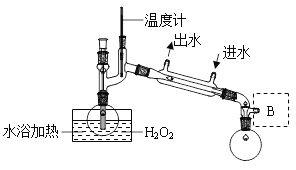
(4) H2O2Ũ�ȶԷ�Ӧ������Ӱ�졣ͨ��ͼ2��ʾװ�ý�����30% H2O2��ҺŨ����40%��B��Ӧ����һ���豸�����豸��������______���������_______��
(5)���˷�����NaClO2�����У����в�������ȷ����_______
A.Ϊ��ֹ��ֽ����ʴ���ò�����ά������ֽ���г���
B.��ת����Һ��©��������Һ������ʱ��ת�Ƴ���
C.ϴ�ӳ���ʱ��Ӧʹϴ�Ӽ�����ͨ������
D.������ϣ��Ͽ�ˮ��������ƿ�����Ƥ�ܺر�ˮ��ͷ
���𰸡� ������ ��ֹH2O2�ֽ⣬ʹClO2Һ�����ٽ�ClO2������ �����ᵼ�·�Ӧ��������ƿ��ClO2Ũ�ȹ��ߣ������ֽ⣬���ʽ��ͣ�������Ӧ�ﷴӦ����� 2ClO3-+2Cl-+4H+=Cl2+2ClO2+2H2O ������ϵ��ѹǿ������H2O�ķе�(�ٽ�H2O������ͬʱ����H2O2�����ȷֽ�Ⱥ��������) H2O C
����������1������A����ȫƿ�������Ƿ�������˫��ˮ�ֽ⣬ClO2���۵㽵�ͣ���˱�ˮԡ��ȴ��Ŀ���Ƿ�ֹH2O2�ֽ⣬ʹClO2Һ�����ٽ�ClO2�����ա���2������������ٹ����ᵼ�·�Ӧ��������ƿ��ClO2Ũ�ȹ��ߣ������ֽ⣬���ʽ��ͣ��������ٹ�����Ӧ�ﷴӦ����֣�ԭ�������ʲ��ߡ���3��Cl-����ʱ���ClO2�����ɣ����ݵڶ�����Ӧ��֪���������ӣ���˵�һ�������������ӣ����ӷ���ʽΪ2ClO3-+2Cl-+4H+=Cl2+2ClO2+2H2O����4��������Ũ��˫��ˮ�����������ˮ����˫��ˮ�ֽ⣬������豸�������Ǽ�����ϵ��ѹǿ������H2O�ķе�(�ٽ�H2O������ͬʱ����H2O2�����ȷֽ��)����5��A.Ϊ��ֹ��ֽ����ʴ���ò�����ά������ֽ���г��ˣ�A��ȷ��B.��ת����Һ��©��������Һ������ʱ��ת�Ƴ�����B��ȷ��C.ϴ�ӳ���ʱ��Ӧ�������ܼ����������ϣ�����Ƭ�̣��ٽ����ɣ�C����D.������ϣ�Ϊ��ֹˮ����������ƿ�ڣ�Ӧ�Ͽ�ˮ��������ƿ�����Ƥ�ܺر�ˮ��ͷ��D��ȷ����ѡC��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��Һ�м����Ȼ�����Һ���ɰ�ɫ�������ټ�ϡ���ᣬ�������ܽ⣬�����Һ��
A. һ����SO42�DB. ���ܺ���CO32�D��SO42�D
C. һ������Ag��D. ���ܺ���SO42�D��Ag��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪�л���A��B��C��D��E��F������ת����ϵ��A�IJ����Ǻ���һ������ʯ�ͻ�������ˮƽ�ı�־��D��ʹʯ����Һ��죻E�Dz�����ˮ�Ҿ���ˮ����ζ����ɫҺ�壬��Է���������C��2����F�����ϵ���Ҫ�ɷ�֮һ����������ʳƷ��װ���������ͼ��ϵ�ش����⣺

��1����Ҫ��ش��������⣺
��д��A��E�Ľṹ��ʽ��A______��E______��
��д��B��C��D��E�й����ŵ����ƣ�B______��C��______D______E��______��
��д����Ӧ�ڵķ�Ӧ����ʽ��_______________________________________
��2��A�뱽����ʯ�ͻ�������Ҫ��Ʒ����һ��������A����ת�����ɱ�����Ҫ��ش��������⣺
�����Է���ȡ����Ӧ��д���ɱ��Ʊ��屽�Ļ�ѧ��Ӧ����ʽ��________________________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����10�֣�A���ɵ��Ȳ����Ƴɵ��ܱ�����,B��һ�ͻ�ѧ��ʴ�����ڴ��ȵ�����.

�ر�K2,��������������NO2ͨ��K1��K3�ֱ����A��B�У���Ӧ��ʼʱ��A��B�������ͬ����֪��2NO2��g��![]() N2O4��g�� ��H��0��
N2O4��g�� ��H��0��
��1��һ��ʱ���Ӧ�ﵽƽ�⣬��ʱA��B�����ɵ�N2O4��������V��A�� V��B������������������������=������������K2������B�� �����������������С�������� ��������ͬ����
��2������A��B���ٳ������ʼ����ȵ�NO2����ﵽƽ��ʱ��NO2��ת��������A���� ��
��ͨ�������Ne������ﵽƽ��ʱ��A��NO2��ת���ʽ� ��B��NO2��ת���ʽ� ��
��3������ʱ����A��B������������䣬��A����һ�����Ȳ㣬B�������Խ����ȴ��ݣ���ﵽƽ��ʱ�� �е���ɫ���
��4����������A�г���4.6g��NO2���ﵽƽ��������ڻ�������ѹǿΪԭ����80%�������ƽ��ʱNO2��ת���ʣ�д��������̣�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�л���A����ʽΪCxHyOz��15g A��ȫȼ������22g CO2��9gH2O��
(1)���л�������ʽ��___________________��
(2)��A��һ����ɫ�ߴ�ǿ���ݼ�����ζ�����壬���л�ԭ�ԣ�����ṹ��ʽ��_________��
(3)A��ֻ��һ�ֹ����ţ���A��Na2CO3���������ų����ʹ��ܷ���������Ӧ����A�Ľṹ��ʽΪ___________________��
(4)A��ֻ��һ�ֹ����ţ���A���ӷ���ˮ����ζ��Һ�壬�ܷ���ˮ�ⷴӦ������ṹ��ʽΪ___________________��
(5)��A����ӽṹ�к���6��̼ԭ�ӣ����ж�Ԫ����ȩ�����ʣ�����ṹ��ʽΪ____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����²����ڻ�ѧ�����ǣ� ��
A. ���Ӽ� B. ���ۼ� C. ������ D. ���Ӽ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����.����CO2��CH4�������ƺϳ���(��Ҫ�ɷ�ΪCO��H2)����֪���������в��ַ�Ӧ���Ȼ�ѧ����ʽΪ��
�� CH4(g) = C(s)+2H2(g) ��H= + 75.0 kJ��mol��1
�� CO2(g)+H2(g)= CO(g)+H2O(g) ��H = + 41.0 kJ��mol��1
�� CO(g)+H2(g) = C(s)+H2O(g) ��H = -131.0 kJ��mol��1
��ӦCO2(g)+CH4(g) = 2CO(g)+2H2(g)�ġ�H =___________kJ��mol��1��
II����CO�ϳ����صķ�ӦΪ��2NH3(g) + CO(g)![]() CO(NH2)2(g) + H2(g) ��H ��0��
CO(NH2)2(g) + H2(g) ��H ��0��
��1��T ��ʱ�������Ϊ2 L�ĺ����ܱ������У�����2 molNH3��1 mol CO������Ӧ��
�� 5 minʱ��Ӧ�ﵽƽ��״̬��CO��ת����Ϊ80%����5 min��NH3��ƽ����Ӧ����Ϊ________�����¶��·�Ӧ��ƽ�ⳣ��K��ֵΪ ____________ ��
�ڶԸ÷�Ӧ������˵����ȷ����______������ĸ����
A���������������ܶȲ��䣬�������Ӧ�ﵽƽ��״̬
B����Ӧ�ﵽƽ��������������䣬�����¶ȣ����صİٷֺ�������
C����Ӧ�ﵽƽ��������������䣬��ԭ�����г���һ����������CO��ת���ʲ���
D����Ӧ�ﵽƽ��������������䣬����һ����NH3��ƽ��������Ӧ�����ƶ�����Kֵ����
��2�������ֺ��º��������������ʵ���֮��Ϊ3 mol��NH3��CO�Բ�ͬ�İ�̼�Ƚ��з�Ӧ�������ͼ��ʾ����ͼ��c��ʾƽ����ϵ�����ص������������b��ʾ________��ת���ʡ������غ������ʱ,��![]() =______����ʱ�����ڸ÷�Ӧ��������Ӧ�����������������������Ĵ�ʩΪ_____��
=______����ʱ�����ڸ÷�Ӧ��������Ӧ�����������������������Ĵ�ʩΪ_____��
��.��ͼ�Ǹ�����(Ag2CrO4)T ��ʱ����ˮ��Һ�еij����ܽ�ƽ�����ߡ�
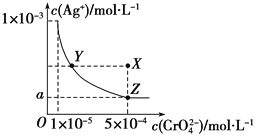
��1����Ag2CrO4��Һ�м������K2CrO4______����ܡ����ܡ���ʹ��Һ��Y���ΪX��
��2��ͼ���� = _________ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������ȷ����
A��������Сѧ��ҧǦ��ͷ�����������Ǧ�ж�
B��ʳ�ü������������������ʹ�������
C �����Ͻ������Ŵ���ܣ����������˺Ͻ�Ӳ�ȴ������
D���ռ�ͱ�������Ϊ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������������ɫ��������ˮ��������Ҳ�Ǹ��ܵ�صĵ缫���ϡ���ҵ��������������Ϊԭ�ϣ�ͨ�����ƣ�FeOOH���Ʊ�������أ��ɽ��������ɱ��Ҳ�Ʒ�����š������������£�
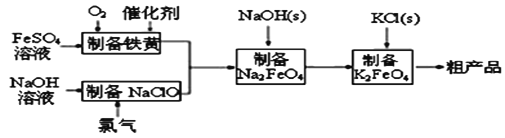
�ش��������⣺
��1����ͬѧ��Ϊ�������̿������ȼҵ���ϡ�д����ⱥ��ʳ��ˮ��ȡ�������ƵĻ�ѧ����ʽ______________��
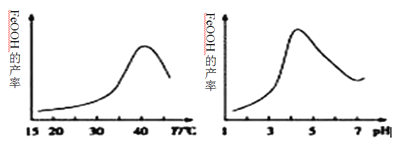
��2���Ʊ����Ƶ����ӷ���ʽΪ_______________��ʵ���÷�Ӧ��Һ��pH���¶ȶ����Ʋ��ʵ�Ӱ����ͼ��ʾ����Ӧ�¶���ѡ��_________��pH����4.5ʱ���Ʋ������͵���Ҫԭ�������_______________��
��3���ø��������ˮ���������˿��Զ�ˮ�����ɱ������֮�⣬�仹ԭ���������������廹������ˮ���������ʣ���д���ø�����س�ȥˮ����CN�������ӷ���ʽ______��
��4����֪�������£�Ksp[Fe(OH)3]=4.0��10��38��������صľ�ˮ�������ˮ��pH�йأ�����ҺpH=2ʱ����ˮ��c��Fe3+��=_________molL��1��
��5��������������У���Ԫ����������Ϊ75%������1L 2molL��1FeSO4��Һ���Ʊ�����Ϊ90%�ĸ������________g��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com