

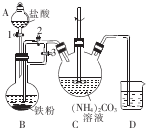
分析 (1)调节溶液pH为碱性环境,以除去溶液中Al3+和Fe3+,可以使之转化为氢氧化物沉淀而除去,根据保证不引入杂质离子来选择合适的调节pH值的试剂;
(2)根据蒸发操作所需仪器来回答;
(3)根据温度过高会导致实验误差来回答;
(4)①根据实验原理,保证碳酸钙和盐酸反应产生的二氧化碳的放出是关键;
②碳酸钙和盐酸反应产生的二氧化碳的量不能受外界空气中二氧化碳和水的干扰;
③根据实验的原理结合化学反应进行计算即可;若无D装置,空气中的二氧化碳有可能被氢氧化钠吸收,导致BaCO3沉淀的质量偏大,据此分析;
④根据装置图可知,在B、C装置中分液漏斗中的液体难以顺利流下,据此答题.
解答 解:(1)调节溶液pH为碱性环境,以除去溶液中Al3+和Fe3+,可以使之转化为氢氧化物沉淀而除去滤渣的主要成分是氢氧化铝和氢氧化铁,为了保证不引入杂质离子,所以中和盐酸的酸性调节pH值可以用氧化钙或是碳酸钙,故选AC,
故答案为:Fe(OH)3、Al(OH)3;AC;
(2)根据蒸发操作所需仪器有玻璃棒、蒸发皿、酒精灯、三脚架,
故答案为:蒸发皿、玻璃棒(坩埚钳);
(3)根据温度过高会导致双氧水分解,引起实验误差,
故答案为:温度过高会导致双氧水分解;
(4)①根据实验原理,保证碳酸钙和盐酸反应产生的二氧化碳的放出是关键,所以从A装置通入空气,目的是保证碳酸钙和盐酸反应产生的二氧化碳全部进入下一个装置,
故答案为:让生成的二氧化碳全部放出,进入C装置,确保实验结果的准确性;
②碳酸钙和盐酸反应产生的二氧化碳的量不能受外界空气中二氧化碳和水的干扰,装置D的作用为防止空气中的CO2与Ba(OH)2溶液反应,
故答案为:防止空气中的CO2与Ba(OH)2溶液反应;
③根据碳酸钙中碳元素守恒,碳酸钙中的碳元素先成为二氧化碳,然后是二氧化碳在和氢氧化钡反应得到碳酸钡沉淀,碳酸钡中的碳元素全部来自碳酸钙中,所以17.73gBaCO3沉淀的物质的量为$\frac{17.73g}{197g/mol}$=0.09mol,所以碳酸钙的物质的量是0.09mol,质量是9g,百分含量是$\frac{9g}{10.00g}$×100%=90.00%,若无D装置,空气中的二氧化碳有可能被氢氧化钠吸收,导致BaCO3沉淀的质量偏大,所以计算出的碳酸钙的质量分数偏大,
故答案为:90.00%;偏大;
④根据装置图可知,在B、C装置中分液漏斗中的液体难以顺利流下,所以B、C装置中,为使分液漏斗中的液体顺利流出,用橡皮管将分液漏斗与锥形瓶、分液漏斗与集气瓶连接成连通装置,
故答案为:B、C装置中,为使分液漏斗中的液体顺利流出,用橡皮管将分液漏斗与锥形瓶、分液漏斗与集气瓶连接成连通装置.
点评 本题目是一道探究物质的含量的综合考查题,要求学生具有分析和解决问题的能力,难度大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
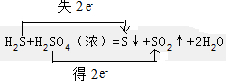 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 乳酸亚铁{[CH3CH(OH)COO]2Fe}广泛应用于乳制品、营养液等,溶于水,可由乳酸与FeCO3反应制得.
乳酸亚铁{[CH3CH(OH)COO]2Fe}广泛应用于乳制品、营养液等,溶于水,可由乳酸与FeCO3反应制得.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 硫元素既被氧化又被还原 | |
| B. | 氧化剂与还原剂的物质的量之比为1:2 | |
| C. | 每生成1molNa2S2O3,转移4mol电子 | |
| D. | 当转移8mol电子时,还原产物比氧化产物多1mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将CO2通入BaCl2溶液中至饱和,无沉淀产生,再通入SO2,产生白色沉淀 | |
| B. | 已知CuS和FeS都难溶于水,将H2S分别通入CuCl2和FeCl2溶液,都会产生沉淀 | |
| C. | 向AlCl3溶液中滴加NaHCO3溶液,产生白色沉淀;再加入NaHSO4溶液,沉淀可消失 | |
| D. | 形状基本一样的纯净锌块和含铜、铁等杂质的锌块分别与相同浓度的稀硫酸反应纯净的锌块反应产生氢气的速率快 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
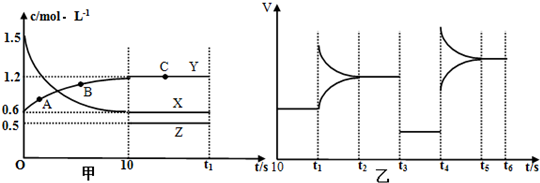
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属钠着火时使用泡沫灭火器灭火 | |
| B. | 用试管加热碳酸氢钠固体时使试管口竖直向上 | |
| C. | 浓硫酸溅到皮肤上时立即用稀氢氧化钠溶液冲洗 | |
| D. | 少量金属汞洒落在实验室地面或桌面时,应立即向汞上撒硫黄粉,然后再清扫 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com