

分析 (1)由图可知B2O3与CaF2和H2SO4反应即生成BF3,同时还应该产生硫酸钙和水,结合原子个数守恒写出方程式;
(2)基态B原子核外有5个电子,根据核外电子排布规律书写电子排布式;依据同周期从左到右电负性依次增强,判断电负性强弱;B第ⅢA族元素,为+3价;
(3)价层电子对互斥理论认为:分子的立体构型是“价层电子对”相互排斥的结果,先判断价层电子对数,再确定构型和杂化方式;价层电子对互斥理论判断其σ电子对和孤电子对数目.
解答 解:(1)由工艺流程可知,B2O3与NH3反应生成BN,根据原子守恒可知,还有水生成,反应方程式为:B2O3+3CaF2+3H2SO4$\frac{\underline{\;\;△\;\;}}{\;}$2BF3↑+3CaSO4+3H2O;B2O3+2NH3$\frac{\underline{\;\;△\;\;}}{\;}$2BN+3H2O;
故答案为:B2O3+3CaF2+3H2SO4$\frac{\underline{\;\;△\;\;}}{\;}$2BF3↑+3CaSO4+3H2O;B2O3+2NH3$\frac{\underline{\;\;△\;\;}}{\;}$2BN+3H2O;
(2)硼原子核外电子数目为5,原子的电子排布式为1s22s22p1;同周期从左到右电负性依次增强,所以电负性N>B;B第ⅢA族元素,为+3价;
故答案为:1s22s22p1;N;+3;
(3)BF3分子的中心原子B原子上含有3个σ 键,中心原子上的孤电子对数=$\frac{1}{2}$(a-xb)=$\frac{1}{2}$(0-3×1)=0,所以BF3分子的VSEPR模型是平面三角型,中心原子上没有孤对电子,所以其空间构型就是平面三角形,键角是120°,BF3分子的中心原子B原子的价层电子对数为;3,属于sp2杂化;BF3和过量NaF作用可生成NaBF4,BF4-中B原子的价层电子对=4+$\frac{1}{2}$=4,该离子中不含孤电子对,为正四面体结构.
故答案为:120°;sp2;正四面体.
点评 本题考查结构性质位置关系、核外电子排布规律、杂化轨道、电负性等,题难度中等,注意对相关知识的应用.


 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案科目:高中化学 来源: 题型:选择题
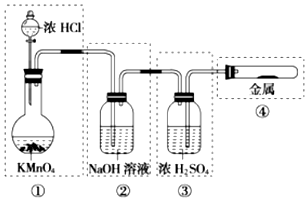
| A. | ①和②处 | B. | ②处 | C. | ②和③处 | D. | ②③④处 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 气体A为SO2和H2的混合物 | B. | 气体A中SO2和H2的体积比为4:1 | ||
| C. | 反应中共消耗Zn 97.5g | D. | 反应中共转移3mol电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 为测定含有Na2O杂质的Na2O2样品的纯度,甲同学设计以下的方案.用如图所示装置,通过测定Na2O2与C02反应生成02的体积来测定样品的纯度.
为测定含有Na2O杂质的Na2O2样品的纯度,甲同学设计以下的方案.用如图所示装置,通过测定Na2O2与C02反应生成02的体积来测定样品的纯度.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X3Y2 | B. | X2Y | C. | Y3X2 | D. | Y2X3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温时,某溶液中由水电离出来的c(H+)和c(OH-)的乘积为l×10-24,该溶液中一定可以大量存在K+、Na+、AlO2-、SO42- | |
| B. | 1 mol Na2O和Na2O2混合物中含有的阴、阳离子总数是3NA | |
| C. | 在中和滴定实验中,既可用标准溶液滴定待测液,也可用待测液滴定标准溶液 | |
| D. | 某一反应体系中的物质有:HC1、SnCl2、H2SnCl6、As、H3AsO3、H2O,已知As是产物之一,则该反应配平后H2O的化学计量数为6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
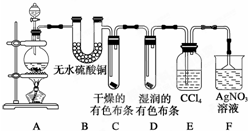 某校化学实验兴趣小组为了探究在实验室制备Cl2的过程中有水蒸气和HCl挥发出来,同时探究氯气的漂白原理,甲同学设计了如图所示的实验装置(支撑用的铁架台省略),按要求回答问题.
某校化学实验兴趣小组为了探究在实验室制备Cl2的过程中有水蒸气和HCl挥发出来,同时探究氯气的漂白原理,甲同学设计了如图所示的实验装置(支撑用的铁架台省略),按要求回答问题.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com