
���� ��1��������Һ�ֱ��������������ʵ���Һ��ϣ������γɰ�ɫ������ֻ��BaSO4��BaCO3��Mg��OH��2����˼�ֻ����Ba��OH��2��0.1mol/L����Һ��c��H+����0.1mol/L��˵��������������Һ�е���AgNO3��Һ�в�����ϡHNO3�İ�ɫ�������ɣ�˵������MgCl2�����Զ���NH4HCO3��
��2���ٲ����ҺA��C��E�ʼ��ԣ�������ҺΪ��Һ��ˮ��ʼ��Ե���Һ���Ҽ���ΪA��E��C����AΪ���Һ�к��д�����OH-���ӣ�OH-������Ag+��Ca2+��Fe2+��Al3+�����Ӳ��ܴ������棬��Aֻ��ΪBa��OH��2������Խ��Խˮ�⣬EӦΪ̼���Σ��������ӹ��棬ֻ��ΪNa2CO3��CΪ̼�����Σ�
����B��Һ�еμ�ϡ��ˮ���ȳ��ֳ����������μӰ�ˮ��������ʧ����B�к��������ӣ�ӦΪ��������Һ�����백ˮ�����ɳ�������������ܽ⣻
����D��Һ�еμ�Ba��NO3��2��Һ������������˵��B�в���SO42-���ӣ�
����F��Һ�еμӰ�ˮ�����ɰ�ɫ��״����������Ѹ�ٱ�ɻ���ɫ������ɺ��ɫ��˵��F�к���Fe2+���ӣ�
��� �⣺��1�����ݢ��е���Ϣ��0.1mol/L����Һ��c��H+����0.1mol/L��˵�����������֪���Ƕ�Ԫ�ᣬ������H2SO4������B��ȷ�����ݢ�����������֪���к���Cl-���ٽ�Ϣ����ṩ��Ϣ�����������������ʻ�Ͼ�������ɫ����������Ƴ�����Ba��OH��2����A��ȷ������H2SO4������MgCl2������NH4HCO3��
a������Ba��OH��2����A��ȷ������H2SO4������MgCl2������NH4HCO3���ʴ�Ϊ��Ba��OH��2��H2SO4��MgCl2��NH4HCO3��
b����������ҺBa��OH��2�����������������ɳ��������ӷ���ʽΪ��Ba2++2OH-+2H++2SO42-=BaSO4��+2H2O��Mg2++2OH-=Mg��OH��2����Ba2++2OH-+NH4++HCO3-=BaCO3��+H2O+NH3•H2O���ʴ�Ϊ��Ba2++2OH-+2H++2SO42-=BaSO4��+2H2O��Mg2++2OH-=Mg��OH��2����Ba2++2OH-+NH4++HCO3-=BaCO3��+H2O+NH3•H2O��
��2��a���ٲ����ҺA��C��E�ʼ��ԣ�������ҺΪ��Һ��ˮ��ʼ��Ե���Һ���Ҽ���ΪA��E��C����AΪ���Һ�к��д�����OH-���ӣ�OH-������Ag+��Ca2+��Fe2+��Al3+�����Ӳ��ܴ������棬��Aֻ��ΪBa��OH��2������Խ��Խˮ�⣬EӦΪ̼���Σ��������ӹ��棬ֻ��ΪNa2CO3��CΪ̼�����Σ�
����B��Һ�еμ�ϡ��ˮ���ȳ��ֳ����������μӰ�ˮ��������ʧ����B�к��������ӣ�ӦΪ��������Һ�����백ˮ�����ķ�ӦΪAgNO3+NH3•H2O=AgOH��+NH4NO3��
AgOH+2NH3•H2O=Ag��NH��3OH+2H2O��
����D��Һ�еμ�Ba��NO3��2��Һ������������˵��B�в���SO42-���ӣ�
����F��Һ�еμӰ�ˮ�����ɰ�ɫ��״����������Ѹ�ٱ�ɻ���ɫ������ɺ��ɫ��˵��F�к���Fe2+���ӣ�
���Ϸ�����֪��AΪBa��OH��2��BΪAgNO3��CΪCa��HCO3��2��DΪAlCl3��EΪNa2CO3��FΪFeSO4��
�ʴ�Ϊ��Ba��OH��2��AgNO3����Ca��HCO3��2��AlCl3��Na2CO3��FeSO4 ��
b������A��Ba��OH��2��D��AlCl3��Ӧ�����ӷ���ʽΪ��Al3++4OH-=AlO2-+2H2O���ʴ�Ϊ��Al3++4OH-=AlO2-+2H2O��
���� ����Ϊ�ƶ��⣬����ʱע�����еķ�Ӧ�����ҳ�ͻ�ƿڣ�ץס���ʵ������ǹؼ���


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
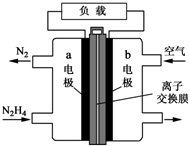 ��Ԫ�ص��⻯����������ڹ�ҵ�������������ж��й㷺Ӧ�ã��ش��������⣺
��Ԫ�ص��⻯����������ڹ�ҵ�������������ж��й㷺Ӧ�ã��ش��������⣺�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
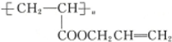 ����A�Ľṹ��ʽΪ ��������
����A�Ľṹ��ʽΪ ��������| A�� | CH3CH2CH2OH | B�� | CH2�TCHCH2OH | C�� | 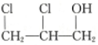 | D�� | 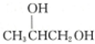 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
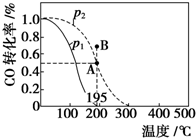 ��20L���ܱ������а����ʵ���֮��Ϊ1��2����CO��H2��������CO��g��+2H2��g��?CH3OH��g����H�����CO��ת�������¶ȼ���ͬѹǿ�µı仯��ͼ��ʾ��p2��195��ʱn��H2����ʱ��ı仯��������ʾ������˵����ȷ���ǣ�������
��20L���ܱ������а����ʵ���֮��Ϊ1��2����CO��H2��������CO��g��+2H2��g��?CH3OH��g����H�����CO��ת�������¶ȼ���ͬѹǿ�µı仯��ͼ��ʾ��p2��195��ʱn��H2����ʱ��ı仯��������ʾ������˵����ȷ���ǣ������� | t/min | 0 | 1 | 3 | 5 |
| n��H2��/mol | 8 | 5 | 4 | 4 |
| A�� | p1��p2����H��0 | |
| B�� | ��p2��195��ʱ����Ӧǰ3 min��ƽ������v��CH3OH��=0.8 mol•L-1•min-1 | |
| C�� | ��p2��195��ʱ���÷�Ӧ��ƽ�ⳣ��Ϊ25 | |
| D�� | ��B��ʱ��v����v�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ��
��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com