
下列实验操作或装置(略去部分夹持仪器)正确的是

A.图①为配制溶液 B.图②为除去CO中的CO2气体
C.图③为制备乙酸乙酯 D.图④为制取收集干燥氨气
 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案科目:高中化学 来源: 题型:
下列说法正确的是
A.阳离子只有氧化性,阴离子只有还原性
B.失电子难的原子获得电子的能力一定强
C.得到电子越多的氧化剂,其氧化性就越强
D.要实现Fe2+→Fe3+的转化,必须加入氧化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
向FeCl2和FeCl3混合溶液中加入适量KOH,高速搅拌下加入油脂,过滤后干燥得到一类特殊的磁流体材料,其化学式通式为KxFeO2(其组成可理解为aK2O·bFeO·cFe2O3)。请回答下列问题:
(1)若x的平均值为1.3,则磁流体中Fe2+和Fe3+的质量之比为 。
(2)若x为1.4,请写出该磁流体在稀硫酸条件下与足量的KI溶液反应的化学方程式:
将该反应设计为原电池,负极电极反应为 ,当消耗1L 1.1mol/L KI溶液时,外电路通过电子数刚好为NA个,则该电池的化学能转化为电能的转化效率为 。
(3)为测定该磁流体中Fe2+的含量,取化学式为K1.5FeO2的样品2g溶解在稀硫酸中并稀释到100ml,取出2mL加入10ml 0.005mol/L的KMnO4(在酸性条件下KMnO4被Fe2+还原为Mn2+),充分反应后再加入150ml 0.001mol/L的FeSO4,溶液紫红色恰好完全褪色,则原样品中Fe2+的质量分数为 。溶解样品若选择稀硝酸测定结果 (填偏高,偏低,无影响)
查看答案和解析>>
科目:高中化学 来源: 题型:
下图是元素周期表短周期的一部分,下列说法正确的是
A.元素①于第二周期第IVA族 B.气态氢化物的稳定性:④>②
C.单质⑤遇足量元素①的氢化物有白烟 D.元素的最高正化合价:③=⑤

查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是
A.HOOC—CH2一CH (OH)一COOH与苹果酸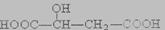 互为同分异构体
互为同分异构体
B.乙醇和甘油互为同系物,它们在铜丝催化氧化后的产物也是同系物
C.糖类、油脂、蛋白质的水解产物都是非电解质
D.浸泡过高锰酸钾溶液的硅藻土可以吸收乙烯,所以可用此物保鲜水果
查看答案和解析>>
科目:高中化学 来源: 题型:
对下列各溶液中,微粒的物质的量浓度关系表述正确的是
A.0.1mol·L-1的(NH4)2CO3溶液中:c(CO32-)>c(NH4+)>c(H+)>c(OH-)
B. 0.1 mol·L-1的NaHCO3溶液中:c(Na+)=c(HCO3-)+c(H2CO3)+2c(CO32-)
C.将0.2 mol·L-1 NaA溶液和0.1 mol·L-1盐酸等体积混合所得碱性溶液中:c(Na+)+c(H+)=c(A-)+c(Cl-)
D.在25℃时,1mol·L-1的CH3COONa溶液中:c(OH-)=c(H+)+c(CH3COOH)
查看答案和解析>>
科目:高中化学 来源: 题型:
在10L恒容密闭容器中充入X(g)和Y(g),发生反应X(g)+Y(g) M(g)+N(g)
M(g)+N(g)
所得实验数据如下表:
| 实验编号 | 温度/℃ | 起始时物质的量/mol | 平衡时物质的量/mol | |
| n(X) | n(Y) | n(M) | ||
| ① | 700 | 0.40 | 0.10 | 0.090 |
| ② | 800 | 0.10 | 0.40 | 0.080 |
| ③ | 800 | 0.20 | 0.30 | a |
| ④ | 900 | 0.10 | 0.15 | b |
回答下列问题:
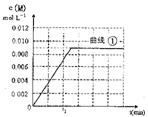
(1)实验①中,若5min时测得,n(M)=0.050mo1, 则0至5min时间内,用N表示的平均反应速率为________。
(2)实验③平衡常数为___________,该正反应为____________反应(填“吸热”或“放热”)
(3)能说明上述反应一定达到平衡的条件是_______________________。
A. c(Y)= c(N) B.平均分子量不再变化
C. v正(X) =v逆(M) D.温度和压强一定时,混合气体的密度不再变化
(4)实验③中,达到平衡时,X的转化率为_________________________。
(5)实验③、④中,达到平衡时,a与b的关系为__________(填选项),请解释原因________________。
A. a>2b B. a=2b C.b<a<2b D.a<b
(6)图是实验①中c(M)随时间变化的曲线图,请在图中画出实验②中c(M)随时间变化的曲线图。
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA为阿伏加德罗常数的值,下列说法正确的是 ( )
A.2.3g金属钠变为Na+时失去的电子数为NA
B.18gH2O所含的原子数目为NA
C.常温下22.4L氢气所含的原子数目为2NA
D.100℃、1.01×105Pa 32gO2所含的分子数为NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com