
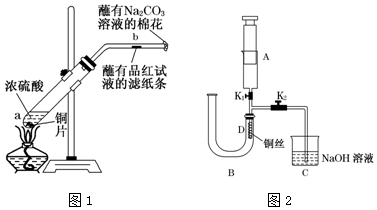
分析 实验一:(1)铜和浓硫酸在加热条件下能发生反应,生成硫酸铜和二氧化硫、水;结合反应方程式计算出转移的电子的物质的量;
(2)二氧化硫能使品红溶液褪色,但二氧化硫的漂白性不稳定,加热时会恢复原来的颜色;
实验二:(1)在A中吸入一定量的空气,然后关闭K1,打开止水夹 K2,使铜与稀硝酸反应生成的一氧化氮进入集气瓶;若U形管右端稀硝酸接触胶塞时,U形管中空气已被排净;
(2)稀硝酸与铜反应生成硝酸铜和NO和水,据此写出反应的离子方程式;
(3)NO为无色,用到空气后一氧化氮与氧气反应生成红棕色的二氧化氮,据此可检验NO.
解答 解:实验一:(1)浓硫酸具有强氧化性,能和铜反应,被铜还原为二氧化硫,所以产物有生成的硫酸铜、二氧化硫和水;书写化学方程式为:Cu+2H2SO4(浓) $\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O;
标况下112mL二氧化硫的物质的量为:$\frac{0.112L}{22.4L/mol}$=0.005mol,生成0.005mol二氧化硫转移的电子为:0.005mol×(6-4)=0.01mol;
故答案为:Cu+2H2SO4(浓) $\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O;0.01 mol;
(2)二氧化硫能和有色物质生成无色物质,二氧化硫能使品红溶液褪色,所以二氧化硫具有漂白性;但生成的无色物质不稳定,加热时会恢复原来的颜色;
故答案为:蘸有品红溶液的滤纸条褪色;滤纸变红;
实验二:(1)在A中吸入一定量的空气,然后关闭K1,打开止水夹K2,使铜与稀硝酸反应生成的一氧化氮进入集气瓶,当U形管右端稀硝酸接触胶塞时,可以确定U形管中空气已被赶尽,
故答案为:关闭;
(2)稀硝酸与铜反应生成硝酸铜和NO,反应的离子方程式为:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O,
故答案为:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O;
(3)B中硝酸和铜反应生成NO,易与氧气反应,则将A中空气压入B中,会有红棕色气体生成,如果观察到红棕色,则说明生成NO而不是氢气,
故答案为:打开止水夹K1,把注射器中的空气压入U形管中,若观察到D处气体变红棕色,则证明收集的是NO,而不是H2.
点评 本题考查了性质实验方案的设计,题目难度中等,熟练掌握浓硫酸、浓硝酸的化学性质为解答关键,明确性质实验方案的设计与评价原则,试题涉及知识点较多、综合性较强,充分考查学生的分析、理解能力及化学实验能力.


科目:高中化学 来源: 题型:多选题
| A. | 一定不存在Ba2+,NH4+可能存在 | B. | CO32-一定存在 | ||
| C. | Na+一定存在 | D. | 一定不存在Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
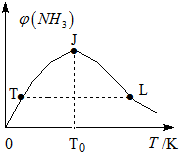 氢气是新型能源和重要化工原料.
氢气是新型能源和重要化工原料.| 容器编号 | 起始时各物质的物质的量/mol | 平衡时反应中的能量变化 | ||
| H2 | N2 | NH3 | ||
| Ⅰ | 3n | n | 0 | 放出热量a kJ |
| Ⅱ | 3n | 2n | 0 | 放出热量b kJ |
| Ⅲ | 6n | 2n | 0 | 放出热量c kJ |
| 时间/min | 0 | 5 | 10 | 15 | 20 | 25 | … |
| NH3/mol | 2 | 1.0 | 0.5 | 0.25 | 0.24 | 0.24 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 纯净水 | B. | 0.lmol/LHCl | C. | 1.0mol/LCH3COOH | D. | 0.5mol/LH2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
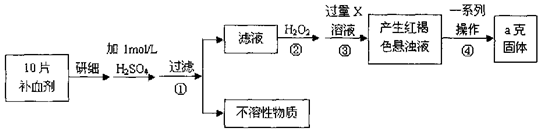
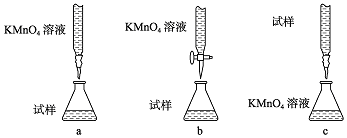
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C+H2O $\frac{\underline{\;高温\;}}{\;}$CO+H2 | B. | 3NO2+H2O=2HNO3+NO | ||
| C. | Cl2+SO2+H2O=H2SO4+2HCl | D. | 2F2+2H2O=4HF+O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | x=0.6a 2Fe2++Cl2=2Fe3++2Cl- | |
| B. | x=a 2Fe2++2Br-+2Cl2=Br2+2Fe3++4Cl- | |
| C. | x=0.4a 2Br-+Cl2=Br2+2Cl- | |
| D. | x=2a 2Fe2++6Br-+4Cl2=3Br2+2Fe3++8Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com