
| A. | HCl溶液中无OH- | |
| B. | NaOH溶液中无H+ | |
| C. | NaCl溶液中既无OH-也无H+ | |
| D. | 常温下,任何物质的水溶液中都有H+和OH-,且KW=c(H+)•c(OH-)=10-14 |
分析 水溶液中一定存在水的电离平衡,H2O?H++OH-,任何物质的水溶液中都含有氢离子和氢氧根离子,温度一定水溶液中存在离子积常数,水的离子积常数只与温度有关,与溶液的酸碱性无关.
解答 解:A.氯化氢溶液中含有氢氧根离子,只是c(H+)远远大于c(OH-),故A错误;
B.氢氧化钠溶液中含有氢离子,只是c(H+)远远小于c(OH-),故B错误;
C.氯化钾溶液中既有氢离子又有氢氧根离子,且c(H+)=c(OH-),故C错误;
D.无论物质是酸、碱还是盐,任何物质的水溶液中都含有H+和OH-,且常温下Kw=c(H+).c(OH-)=1×10-14,故D正确.
故选D.
点评 本题考查了c(H+)、c(OH-)和溶液的关系,注意任何物质的水溶液中都含有氢离子和氢氧根离子,无论溶质是酸、碱还是盐,很多学生认为酸中没有氢氧根离子,碱中没有氢离子,为易错点,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:实验题
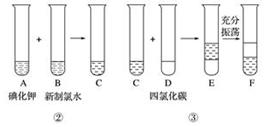
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 分类组合 | 碱 | 酸 | 盐 | 氧化物 |
| A | Na2CO3 | H2SO4 | NaCl | CO2 |
| B | NaOH | HCl | NaHCO3 | H2SiO3 |
| C | NaOH | H2CO3 | CaCl2 | SO2 |
| D | KOH | NaHSO4 | CaCO3 | CO2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.4g金属镁变为镁离子时失去的电子数为0.1NA | |
| B. | 1.8g的NH4+离子中含有的电子数为NA | |
| C. | 53g碳酸钠中含NA个CO32- | |
| D. | 同温同压下,相同体积的任何气体单质所含的原子数相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaNO2是氧化剂 | B. | NaNO2在反应中失电子 | ||
| C. | NH4Cl中的N元素被还原 | D. | N2既是氧化剂又是还原剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 实验室制取溴乙烷的主反应如下:
实验室制取溴乙烷的主反应如下:| 相对分子质量 | 密度/(g•cm-3) | 沸点/℃ | 溶解度 | |
| 乙 醇 | 46 | 0.789 | 78.3 | 易溶 |
| 溴乙烷 | 109 | 1.46 | 38.2 | 难溶 |
| 浓硫酸 | 98 | 1.84 | 338.0 | 易溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子的还原性强弱:I->Fe2+>Br- | |
| B. | 当a≥b时,发生的离子反应:2I-+Br2=I2++2Br- | |
| C. | 当3a≤2b时,发生的离子反应:2Fe2++2I-+2Br2=2Fe3++I2+4Br- | |
| D. | 当5a=4b时,反应后的离子浓度之比:c(Fe2+):c(Fe3+):c(Br-)=1:1:5 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com