
| 项目 | pH | Ca2+、Mg2+总浓度 | 细菌个数 |
| 相关值 | 6.5~8.5 | <0.0045mol?L-1 | <100个?mL-1 |



科目:高中化学 来源: 题型:
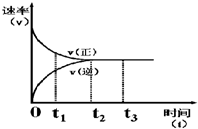 如图是可逆反应X+Y?Z 在反应过程中的反应速率(v)与时间(t)的关系曲线,下列叙述正确的是 ( )
如图是可逆反应X+Y?Z 在反应过程中的反应速率(v)与时间(t)的关系曲线,下列叙述正确的是 ( )| A、t1时,只有正方向反应 |
| B、t2-t3,各物质的浓度相等 |
| C、t2-t3,反应不再发生 |
| D、t2时,达到该条件下的反应限度 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na2O |
| B、Na2CO3 |
| C、NaHCO3 |
| D、Ca(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| m-n | 0 | 1 | 2 | 3 |
| 含氧酸强度 | 弱酸 | 中强 | 强 | 很强 |
| 实例 | HClO | H3PO4 | HNO3 | HClO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 能量是一个世界性的话题,如何充分利用能量、开发新能源,为人类服务是广大科技工作者不懈努力的目标.
能量是一个世界性的话题,如何充分利用能量、开发新能源,为人类服务是广大科技工作者不懈努力的目标.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温常压下是气体 |
| B、常温常压下性质很稳定 |
| C、不能使酸性高锰酸钾溶液褪色 |
| D、可以使溴水褪色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com