
 有关短周期元素A、B、C、D、E、F的信息如下:
有关短周期元素A、B、C、D、E、F的信息如下:| 元素 | 有关信息 |
| A | 最高价氧化物对应的水化物(甲)能与其气态氢化物(乙)反应生成盐 |
| B | 最外层电子数是次外层电子数的2倍 |
| C | M层上有3个电子 |
| D | 短周期原子半径最大的主族元素 |
| E | 其单质是淡黄色固体 |
| F | 最高正价与最低负价代数和为6 |
| ||
| ||
| 35.7% |
| 35.5 |
| 64.7% |
| 64 |


科目:高中化学 来源: 题型:
| 试管 | 盐酸浓度 | 温度 | 锌的状态 |
| A | 0.5mol?L-1 | 20℃ | 块 状 |
| B | 0.5mol?L-1 | 20℃ | 粉末状 |
| C | 2mol?L-1 | 35℃ | 粉末状 |
| D | 1.8mol?L-1 | 35℃ | 粉末状 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
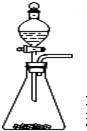
 有两个实验小组的同学为探究过氧化钠与二氧化硫的反应,都用如图所示的装置进行实验.通入SO2气体,将带余烬的木条插入试管C,木条复燃.请回答下列问题:
有两个实验小组的同学为探究过氧化钠与二氧化硫的反应,都用如图所示的装置进行实验.通入SO2气体,将带余烬的木条插入试管C,木条复燃.请回答下列问题:
查看答案和解析>>
科目:高中化学 来源: 题型:
 合成氨反应N2(g)+3H2(g)=2NH3(g),反应过程的能量变化如图所示.已知N2(g)与H2(g)反应生成17g NH3(g),放出46.1kJ的热量.
合成氨反应N2(g)+3H2(g)=2NH3(g),反应过程的能量变化如图所示.已知N2(g)与H2(g)反应生成17g NH3(g),放出46.1kJ的热量.查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素 | A | B | C | D |
| 性质结构信息 | 室温下单质呈粉末状固体,加热易熔化;单质在氧气中燃烧,发出明亮的蓝紫色火焰 | 单质常温、常压下是气体,能溶于水;原子的M层上只有1个未成对的p电子 | 单质质软、银白色固体、导电性强;单质在空气中燃烧发出黄色火焰 | 原子最外电子层上s电子数等于p电子数;单质为空间网状晶体,具有很高的熔、沸点 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 结构简式 | 系统命名法命名 | |
| 可能1 | ||
| 可能2 | ||
| … |
查看答案和解析>>
科目:高中化学 来源: 题型:
+ 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com