
| A. | 向NaA1O2溶液中通入过量CO2:2A1O2-+CO2+3H2O═2Al (OH)3↓+CO32- | |
| B. | 钠与氢氧化钠溶液反应:2Na+2H2O═2Na++H2↑+2OH- | |
| C. | 用足量的氨水处理硫酸工业的尾气:SO2+NH3•H2O═NH4++HSO3- | |
| D. | 向氯化铁溶液中插入铜片:2Fe3++Cu═2Fe+Cu2+ |
分析 A.二氧化碳过量反应生成氢氧化铝和碳酸氢钠;
B.钠与氢氧化钠溶液反应实质是钠与水反应生成氢氧化钠和氢气;
C.氨水过量反应生成亚硫酸铵;
D.氯化铁与铜反应生成氯化亚铁和氯化铜.
解答 解:A.向NaA1O2溶液中通入过量CO2,离子方程式:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-,故A错误;
B.钠与氢氧化钠溶液反应,离子方程式:2Na+2H2O═2Na++H2↑+2OH-,故B正确;
C.用足量的氨水处理硫酸工业的尾气:SO2+2NH3•H2O=2NH4++H2O+SO32-,故C错误;
D.向氯化铁溶液中插入铜片,离子方程式:2Fe3++Cu═2Fe2++Cu2+,故D错误;
故选:B.
点评 本题考查了离子方程式的书写,侧重考查反应物用量不同的离子反应,熟悉反应的实质是解题关键,题目难度中等.


科目:高中化学 来源: 题型:解答题
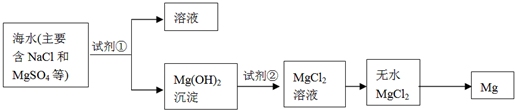


查看答案和解析>>
科目:高中化学 来源: 题型:解答题
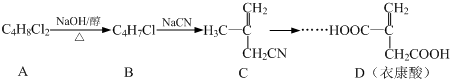
 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知0.1 mol•L-1的醋酸溶液中存在电离平衡:CH3COOH?CH3COO-+H+,加少量烧碱溶液可使溶液中c(H+)/c(CH3COOH)值增大 | |
| B. | 25℃时,向水中加入少量固体CH3COONa,水的电离平衡:H2O?H++OH-逆向移动,c(H+)降低 | |
| C. | 取c(H+)=0.01mol/L的盐酸和醋酸各100mL,分别稀释2倍后,再分别加入 0.03g锌粉,在相同条件下充分反应,醋酸与锌反应的速率大 | |
| D. | 常温下,将pH=11的Ba(OH)2溶液加水稀释10倍后,溶液的pH=12 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
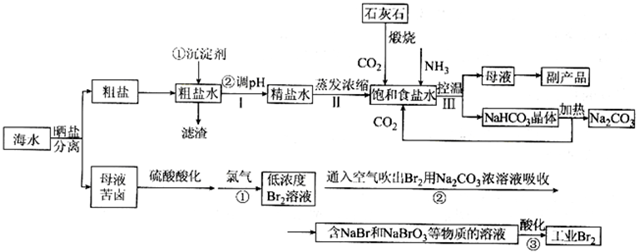
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3CH3+Cl2$\stackrel{光}{→}$CH3CH2Cl+HCl | |
| B. | 2CH3CH2OH+O2$→_{△}^{催化剂}$2CH3CHO+2H2O | |
| C. | 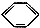 +Br2$\stackrel{Fe}{→}$ +Br2$\stackrel{Fe}{→}$ Br+HBr Br+HBr | |
| D. | CH2═CH2+Br2→CH2Br-CH2Br |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{100W}{36a}$×100% | B. | $\frac{W}{36a+W}$×100% | C. | $\frac{W}{3600a+W}$×100% | D. | $\frac{100W}{36a+W}$×100% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X是SO2,它既有氧化性又有还原性 | |
| B. | 干燥的气体Y不能使干燥的有色布条褪色,其水溶液具有漂泊作用的是HClO | |
| C. | Z与水反应的化学方程式为:3NO2+H2O=2HNO3+NO | |
| D. | 等物质的量的X与Y同时通入到湿润的有色布条上,有色布条褪色时间变短,漂泊效果增强 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com