
 某温度时,在2L密闭容器中有X、Y、Z三种气态物质,实验测得不同时刻各物质的量如下表所示,同时测得至3min时吸收热量75kJ.
某温度时,在2L密闭容器中有X、Y、Z三种气态物质,实验测得不同时刻各物质的量如下表所示,同时测得至3min时吸收热量75kJ. | t/min | X/mol | Y/mol | Z/mol |
| 0 | 1.00 | 1.00 | 0.00 |
| 3 | 0.75 | 0.50 | 0.50 |
| 5 | 0.65 | 0.30 | 0.70 |
| 9 | 0.60 | 0.20 | 0.80 |
| 14 | 0.60 | 0.20 | 0.80 |
分析 (1)根据表中数据知,随着反应的进行,X、Y的物质的量减少而Z的物质的量增大,说明X和Y是反应物而Z是生成物,9min时各物质的物质的量不变,说明该反应达到平衡状态,则△n(X)=(1.00-0.60)mol=0.40mol,
△n(Y)=(1.00-0.20)mol=0.80mol,△n(Z)=(0.80-0.00)mol=0.80mol,同一反应中参加反应的各物质的物质的量之比等于其计量数之比,所以X、Y、Z的计量数之比=0.40mol:0.80mol:0.80mol=1:2:2,3min时参加反应的X的物质的量=(1.00-0.75)mol=0.25mol,放出的热量是75kJ,则1molX完全反应放出的热量为300kJ,据此书写其热化学方程式;
(2)平衡时c(X)=$\frac{0.60mol}{2L}$=0.30mol/L,c(Y)=$\frac{0.20mol}{2L}$=0.10mol/L,c(Z)=$\frac{0.80mol}{2L}$=0.40mol/L,根据平衡常数公式计算其化学平衡常数;
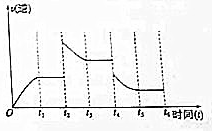
(3)①根据图知,t2改变条件时,逆反应速率增大,且达到平衡状态时反应速率大于原来平衡反应速率,所以改变条件瞬间逆反应速率大于正反应速率;
②t4改变条件时,平衡速率小于原来平衡速率,且随着反应进行,逆反应速率减小,则正反应速率应该增大,平衡逆向移动,且改变条件瞬间正逆反应速率都小于原来平衡速率,改变的条件应该是温度.
解答 解:(1)根据表中数据知,随着反应的进行,X、Y的物质的量减少而Z的物质的量增大,说明X和Y是反应物而Z是生成物,9min时各物质的物质的量不变,说明该反应达到平衡状态,则△n(X)=(1.00-0.60)mol=0.40mol,
△n(Y)=(1.00-0.20)mol=0.80mol,△n(Z)=(0.80-0.00)mol=0.80mol,同一反应中参加反应的各物质的物质的量之比等于其计量数之比,所以X、Y、Z的计量数之比=0.40mol:0.80mol:0.80mol=1:2:2,3min时参加反应的X的物质的量=(1.00-0.75)mol=0.25mol,放出的热量是75kJ,则1molX完全反应放出的热量为300kJ,其热化学方程式为:X(g)+2Y(g)?2Z(g)△H=-300kJ/mol,
故答案为:X(g)+2Y(g)?2Z(g)△H=-300kJ/mol;
(2)平衡时c(X)=$\frac{0.60mol}{2L}$=0.30mol/L,c(Y)=$\frac{0.20mol}{2L}$=0.10mol/L,c(Z)=$\frac{0.80mol}{2L}$=0.40mol/L,K=$\frac{(0.40)^{2}}{0.30×(0.10)^{2}}$=$\frac{1600}{9}$,
故答案为:$\frac{1600}{9}$;
(3)①根据图知,t2改变条件时,逆反应速率增大,且达到平衡状态时反应速率大于原来平衡反应速率,所以改变条件瞬间逆反应速率大于正反应速率,平衡逆向移动,故答案为:逆;
②t4改变条件时,平衡速率小于原来平衡速率,且随着反应进行,逆反应速率减小,则正反应速率应该增大,平衡逆向移动,且改变条件瞬间正逆反应速率都小于原来平衡速率,改变的条件应该是降低温度,故选B.
点评 本题考查化学平衡计算,为高频考点,涉及化学平衡常数计算、化学平衡图象分析,侧重考查学生分析计算能力,难点是图象分析,要根据曲线变化趋势及特点结合方程式确定改变条件,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题




查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2HCl+2Na═2NaCl+H2↑ | |
| B. | 2CH3COOH+Ca(ClO)2═2HClO+Ca(CH3COO)3 | |
| C. | I2+2NaClO3═2NaIO3+Cl2 | |
| D. | 4HCl(浓)+MnO2$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 A,B,C,D,E是五种短周期元素,A,B,C,D,E分别代表元素符号,他们的原子序数依次增大,A是元素周期表中半径最小的元素;B元素最高价氧化物对应的水化物与其氢化物反应生成一种盐;D与A同主族,且与E同周期;E元素最外层电子数是其次外层电子数的$\frac{3}{4}$;C与E同主族.请回答下列问题:
A,B,C,D,E是五种短周期元素,A,B,C,D,E分别代表元素符号,他们的原子序数依次增大,A是元素周期表中半径最小的元素;B元素最高价氧化物对应的水化物与其氢化物反应生成一种盐;D与A同主族,且与E同周期;E元素最外层电子数是其次外层电子数的$\frac{3}{4}$;C与E同主族.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0~1min,CO的平均反应速率为o.5mol/(L•min) | |
| B. | 增大压强,化学反应速率加快,K增大 | |
| C. | H2S的平衡转化率为71.4% | |
| D. | 平衡后,又加入CO、H2各1mol,平衡逆动 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题


查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com