
【题目】水的电离平衡曲线如图所示:
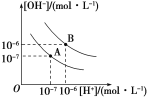
(1)若以A点表示25 ℃时水电离平衡时的离子浓度,当温度上升到100 ℃时,水的电离平衡状态到B点,则此时水的离子积从________增加到________。
(2)将pH=8的氢氧化钡溶液与pH=5的盐酸溶液混合并保持100 ℃恒温,欲使混合溶液的pH=7,则氢氧化钡溶液与盐酸的体积比为________。
(3)已知AnBm的离子积K=[Am+]n·[Bn-]m,在某温度下,氢氧化钙溶解度为0.74 g,其饱和溶液密度设为1 g·cm-3,其离子积为K=________。
【答案】1×10-141×10-122∶90.004
【解析】
(1)由水的离子积定义式和图中氢离子和氢氧根离子的浓度可知A到B,水的离子积从1×10-14 变化到1×10-12;(2)设氢氧化钡溶液和盐酸的体积分别为Vb、Va,(10-12/10-8Vb-10-5Va)/(Va+Vb)=10-12/10-7,Vb/Va=2∶9,故答案为2∶9;(3)因为氢氧化钙的溶解度为0.74 g,所以该温度下1 000 g饱和氢氧化钙溶液含氢氧化钙质量为7.4 g,氢氧化钙物质的量为0.1 mol,即[Ca2+]=0.1 mol·L-1,[OH-]=0.2 mol·L-1,所以K=[Ca2+]·[OH-]2=0.004,故答案为:0.004。


科目:高中化学 来源: 题型:
【题目】下列有关化学反应的说法中,不正确的是( )
A. 化学反应一定伴随能量变化
B. 化学键的断裂和形成是化学反应中能量变化的主要原因
C. 放热反应中反应物的总能量大于生成物的总能量
D. 需要加热才能发生的反应一定是吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向2L的密闭容器中充入7.6mol NO和3.8mol O2,发生如下反应:
①2NO(g)+O2(g)![]() 2NO2(g)
2NO2(g)
②2NO2(g)![]() N2O4(g)
N2O4(g)
测得NO2和N2O4的浓度变化如图所示,0~10min维持容器温度为T1℃,10min后升高并维持容器的温度为T2℃。下列说法正确的是

A. 前5min的平均反应速率v(N2O4)=0.18mol·L-1·s-1
B. T1℃时反应②的化学平衡常数K=0.6
C. 反应①、②均为吸热反应
D. 若起始时向该容器中充入3.6mol NO2和2.0mol N2O4,T1℃达到平衡时,N2O4的转化率为10%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值。下列叙述正确的是
A. 1 mol Fe与1 mol Cl2充分反应生成FeCl3时,转移电子数为3NA
B. 通常状况下,11.2 LH2所含的氢原子数为NA
C. 1 mol羟基与17 g NH3所含电子数之比为9∶10
D. 一定温度下,1 L 0.5 mol·L-1 NH4Cl溶液与2 L 0.25 mol·L-1 NH4Cl溶液含NH![]() 的物质的量相同
的物质的量相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质在水中可能存在电离平衡、盐的水解平衡和沉淀的溶解平衡,它们都可看作化学平衡。请根据所学知识回答:
(1)A为0.1 mol·L-1的(NH4)2SO4溶液,在该溶液中各种离子的浓度由大到小的顺序为______________________________________。
(2)B为0.1 mol·L-1 NaHCO3溶液,请分析NaHCO3溶液显碱性的原因___________________________________________________。
(3)C为FeCl3溶液,实验室中配制FeCl3溶液时常加入________溶液以抑制其水解,若把B和C溶液混合,将产生红褐色沉淀和无色气体,该反应的离子方程式为___________________________。
(4)D为含有足量AgCl固体的饱和溶液,氯化银在水中存在沉淀溶解平衡:AgCl(s)![]() Ag+(aq)+Cl-(aq),在25 ℃时,氯化银的Ksp=1.8×10-10。现将足量氯化银分别放入:①100 mL 蒸馏水中;②100 mL 0.2 mol·L-1 AgNO3溶液中;③100 mL 0.1 mol·L-1氯化铝溶液中;④100 mL 0.1 mol·L-1盐酸溶液中,充分搅拌后,相同温度下银离子浓度由大到小的顺序是________(填写序号);②中氯离子的浓度为___mol·L-1。
Ag+(aq)+Cl-(aq),在25 ℃时,氯化银的Ksp=1.8×10-10。现将足量氯化银分别放入:①100 mL 蒸馏水中;②100 mL 0.2 mol·L-1 AgNO3溶液中;③100 mL 0.1 mol·L-1氯化铝溶液中;④100 mL 0.1 mol·L-1盐酸溶液中,充分搅拌后,相同温度下银离子浓度由大到小的顺序是________(填写序号);②中氯离子的浓度为___mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列选项中,为完成相应实验,所用仪器或相关操作合理的是( )
A | B | C | D |
配制1mol/L AlCl3溶液 | 实验室制取 氢气 | 比较硫、碳、硅三种 元素的非金属性强弱 | 盛装NaOH 溶液 |
|
|
|
|
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新型镁铝合金(Mg17Al12)(合金中金属化合价均为0)有储氢性能,下列说法正确的是( )
A. 该合金应在氮气保护下,将一定比例的Mg、Al单质熔炼而成
B. 1molMg17Al12与盐酸完全反应放出H2为35mol
C. 一定量的镁铝合金既可以完全溶于足量盐酸中,也可以完全溶于足量的NaOH溶液中
D. 等质量的镁、铝、和镁铝合金分别与足量的盐酸反应生成H2的体积(同温同压下)由大到小的顺序为:V(Mg)>V(合金)>V(Al)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物的分子式为C5H8O,其能发生银镜反应,也能与Br2发生加成反应,若将它与H2加成,所得产物不可能是下列有机物中的( )
①(CH3)3CCH2OH ②(CH3CH2)2CHOH ③CH3(CH2)3CH2OH ④(CH3)2CHCH2CH2OH ⑤CH3CH2CH(CH3)CH2OH
A.①②B.③④C.①②③④⑤D.②⑤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com