
【题目】铁铬氧化还原液流电池是一种低成本的储能电池,电池结构如图所示,工作原理为Fe3++Cr2+![]() Fe2++Cr3+。下列说法正确的是( )
Fe2++Cr3+。下列说法正确的是( )
![]()
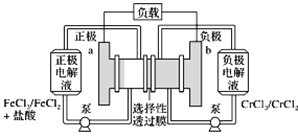
A. 电池放电时,a极的电极反应式为Fe3++3e===Fe
B. 电池放电时,电路中每通过0.1 mol电子,Fe3+浓度降低0.1 mol·L1
C. 电池充电时,Cl从a极穿过选择性透过膜移向b极
D. 电池充电时,b极的电极反应式为Cr3++e===Cr2+
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】已知A是用来衡量一个国家石油化工发展水平的标志性物质,A、B、C、D、E、F、G均为有机物,他们之间有如图所示的转化关系,请回答下列问题:
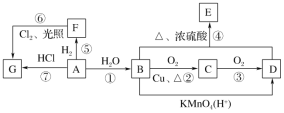
(1)A中官能团的名称为____________,B中官能团的电子式为____________。
(2)在F的同系物中最简单的有机物的空间构型为____________。
(3)写出下列编号对应反应的化学方程式,并注明反应类型:
④___________________________________________________,___________________;
⑦___________________________________________________,___________________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】运用化学反应原理研究碳、氮、硫的单质及其化合物的反应对缓解环境污染、能源危机具有重要意义。
I.氨为重要的化工原料,有广泛用途。
(1)合成氨中的氢气可由下列反应制取:
a. CH4(g)+H2O(g)CO(g)+3H2(g) H1=+216.4kJ/mol
b. CO(g)+H2O(g)CO2(g)+H2(g) H2=-41.2kJ/mol
则反应CH4(g)+2H2O(g)CO2(g)+4H2(g) H= _____________。
(2)起始时投入氮气和氢气的物质的量分别为1mol、3mol,在不同温度和压强下合成氨。平衡时混合物中氨的体积分数与温度的关系如图。

①恒压时,反应一定达到平衡状态的标志是_____________(填序号)
A.![]() 和
和![]() 的转化率相等 B.反应体系密度保持不变
的转化率相等 B.反应体系密度保持不变
C.![]() 保持不变 D.
保持不变 D.![]()
②P1_____P2 (填“>”“=”或“不确定”,下同);反应的平衡常数:B点_______D点。
③C点![]() 的转化率为________;在A、B两点条件下,该反应从开始到平衡时生成氮气的平均速率:υ(A)__________υ(B)。
的转化率为________;在A、B两点条件下,该反应从开始到平衡时生成氮气的平均速率:υ(A)__________υ(B)。
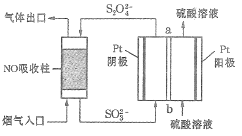
Ⅱ.用间接电化学法去除烟气中NO的原理如下图所示。
已知阴极室溶液呈酸性,则阴极的电极反应式为_____________。反应过程中通过质子交换膜(ab)的![]() 为2mol时,吸收柱中生成的气体在标准状况下的体积为_____________L。
为2mol时,吸收柱中生成的气体在标准状况下的体积为_____________L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上利用硫铁矿烧渣(主要成分为Fe2O3、FeO、SiO2等)为原料制备高档颜料铁红(Fe2O3),具体生产流程如图:
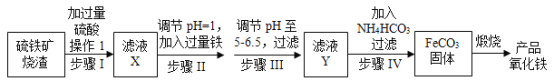
试回答下列问题:
(1)滤液X中含有的金属阳离子是___(填离子符号)。
(2)步骤Ⅱ中发生反应的离子方程式为_____。
(3)步骤Ⅲ中最好可选用___(填字母)调节溶液的pH。
A.稀硝酸 B.氨水 C.氢氧化钠溶液 D.高锰酸钾溶液
(4)步骤Ⅳ中,FeCO3沉淀完全后,溶液中含有少量Fe2+,检验Fe2+的方法是___。
(5)步骤Ⅳ的反应温度一般需控制在35℃以下,其目的是______。
(6)在空气中煅烧FeCO3生成产品氧化铁的化学方程式为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏伽德罗常数的值,下列说法错误的是
A.l00g质量分数为46%的乙醇水溶液中氧原子数为4NA
B.向FeI2溶液中通人适量Cl2,当有1mol Fe2+被氧化时,反应转移电子数目为3NA
C.某温度下,1L pH=2的H2SO4溶液中,硫酸和水电离出的H+总数为0.01NA
D.常温下,1L 0.1mol·L1醋酸钠溶液中加入醋酸至中性,则溶液中CH3COO-数为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气中含有CO、NOx等有毒气体,对汽车加装尾气净化装置,可使有毒气体相互反应转化为无毒气体。
(1)已知 4CO(g)+2NO2(g)![]() 4CO2(g)+N2(g) ΔH= -1200kJ·mol-1
4CO2(g)+N2(g) ΔH= -1200kJ·mol-1
①该反应在________________(填“高温、低温或任何温度”)下能自发进行。
②对于该反应,改变某一反应条件(温度T1>T2),下列图像正确的是_______(填序号)。
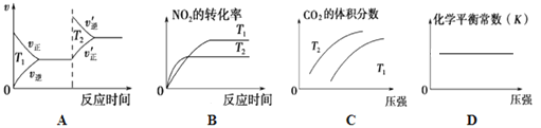
③某实验小组模拟上述净化过程,一定温度下,在 2L的恒容密闭容器中,起始时按照甲、乙两种方式进行投料,经过一段时间后达到平衡状态,测得甲中CO的转化率为50%,则该反应的平衡常数为__________;两种方式达平衡时,N2的体积分数:甲______乙( 填“>、=、<或不确定”,下同),NO2的浓度:甲______乙。
甲 | 乙 |
0.2mol NO2 | 0.1mol NO2 |
0.4mol CO | 0.2mol CO |
(2)柴油汽车尾气中的碳烟(C)和NOx可通过某含钴催化剂催化消除。不同温度下,将模拟尾气(成分如下表所示)以相同的流速通过该催化剂测得所有产物(CO2、N2、N2O)与NO的相关数据结果如图所示。
模拟尾气 | 气体(10mol) | 碳烟 | ||
NO | O2 | He | ||
物质的量(mol) | 0.025 | 0.5 | 9.475 | a |
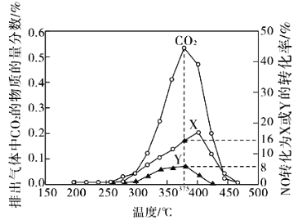
①375℃时,测得排出的气体中含0.45mol O2和0.0525mol CO2,则Y的化学式为________。
②实验过程中采用NO模拟NOx,而不采用NO2的原因是______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在两份相同的Ba(OH)2溶液中,分别滴入物质的量浓度相等的H2SO4、NaHSO4溶液,其导电能力随滴入溶液体积变化的曲线如图所示。下列分析正确的是

A.b→d反应的离子方程式为:H++OH-=H2O
B.o→a反应的离子方程式为:Ba2++OH-+H++SO42-=BaSO4↓+H2O
C.c点导电能力相同,所以两溶液中含有相同量的OH–
D.a、b两点Ba2+均沉淀完全,所以对应的溶液均显中性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用下述装置制取氯气,并用氯气进行下列实验。看图回答下列问题:
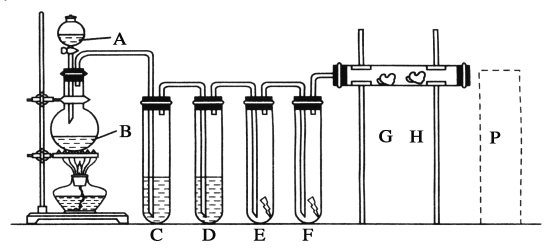
(1)A、B两仪器的名称:A________,B________。
(2)洗气装置C是为了除去Cl2中的HCl气体,D是为了干燥Cl2,则C、D中应分别放入下列溶液中的C______________;D______________。
①NaOH溶液 ②饱和食盐水 ③AgNO3溶液 ④浓H2SO4
(3)E中为红色干布条,F中为红色湿布条,可观察到的现象是______________________________。
(4)G是浸有淀粉KI溶液的棉花球,G处现象是棉花球表面变成____________。反应的离子方程式是______________________,H是浸有NaBr溶液的棉花球,H处现象是棉花球表面变成________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com