
 优加精卷系列答案
优加精卷系列答案科目:高中化学 来源: 题型:
| 1 |
| 22.4 |
| 1 |
| 22.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 (2013?日照二模)CO、NO、NO2、SO2等都是污染大气的有害气体,对其进行回收利用是节能减排的重要课题.
(2013?日照二模)CO、NO、NO2、SO2等都是污染大气的有害气体,对其进行回收利用是节能减排的重要课题.c(N
| ||
| c(NH3?H2O) |
查看答案和解析>>
科目:高中化学 来源: 题型:
 4NO+6H2O
4NO+6H2O 4NO+6H2O
4NO+6H2O +HNO3(浓)
+HNO3(浓)| H2SO4(浓) |
| 50-60℃ |
 -NO2+H2O
-NO2+H2O +HNO3(浓)
+HNO3(浓)| H2SO4(浓) |
| 50-60℃ |
 -NO2+H2O
-NO2+H2O查看答案和解析>>
科目:高中化学 来源: 题型:
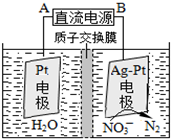 氮氧化合物是大气污染的重要因素.
氮氧化合物是大气污染的重要因素.| 催化剂 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com