
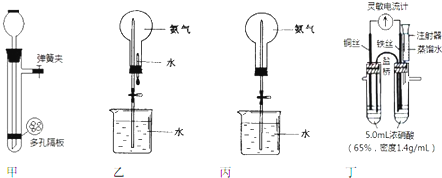
分析 (1)装置气密性检验的原理是:通过气体发生器与附设的液体构成封闭体系,依据改变体系内压强时产生的现象(如气泡的生成、水柱的形成、液面的升降等)来判断装置气密性的好坏;
(2)锌与稀硫酸反应,加入少量硫酸铜,能形成原电池,所以反应速率加快;
(3)利用氨气极易溶于水,形成压强差而形成喷泉;
(4)根据利用气体受热膨胀(受冷压缩)而使烧瓶的压强增大(减小),氨气逸出(压强减小)溶解而形成喷泉进行解答;
(5)反应过程中所生产的氮的氧化物是有毒气体会污染空气;
(6)指针偏转指向铜说明铜失电子做负极,正极是溶液中硝酸根离子得到电子发生还原反应;
(7)依据溶质守恒计算.
解答 解:(1)装置气密性检验的原理是:通过气体发生器与附设的液体构成封闭体系,依据改变体系内压强时产生的现象(如气泡的生成、水柱的形成、液面的升降等)来判断装置气密性的好坏,制备氢气前检验装置的气密性为:塞紧橡皮塞,夹紧弹簧夹后,往长颈漏斗中加水,使漏斗导管的液面高于试管的液面,液面差保持不变一段时间,说明气密性良好,故答案为:塞紧橡皮塞,夹紧弹簧夹后,往长颈漏斗中加水,使漏斗导管的液面高于试管的液面,液面差保持不变一段时间,说明气密性良好;
(2)锌与稀硫酸反应,加入少量硫酸铜,能形成原电池,方程式为:Zn+Cu2+=Cu+Zn2+,所以反应速率加快,故答案为:Zn+Cu2+=Cu+Zn2+,形成铜锌原电池,使反应速率加快;
(3)氨气极易溶于水,如果打开止水夹,氨气溶于水后烧瓶内压强迅速减小,而形成喷泉,故答案为:打开止水夹;
(4)装置丙没有胶头滴管,打开止水夹,用手(或热毛巾等)将烧瓶捂热,氨受热膨胀,气体从烧瓶中逸出,赶出玻璃导管中的空气,氨气极易溶于水,氨气与水接触,烧瓶内压强减小,即发生喷泉,或者用冰块捂住烧瓶,使瓶内气体体积缩小,压强减小,故打开止水夹,水进入瓶内,故答案为:ab;
(5)反应过程中所生产的了氮的氧化物是有毒气体会污染空气,该实验装置的不足之处是没有尾气处理装置,故答案为:没有尾气处理装置;
(6)指针偏转指向铜说明铜失电子做负极,正极是溶液中硝酸根离子得到电子发生还原反应,电极反应为:NO3-+e-+2H+═NO2↑+H2O,故答案为:NO3-+e-+2H+═NO2↑+H2O;
(7)使铁钝化的硝酸最低浓度=$\frac{5.0×1.4×65%}{5.0×1.4+2.5}$×100%=47.9%,故答案为:47.9%.
点评 本题主要考查了实验室中氢气的制取方法、氨气的喷泉实验、原电池原理的分析应用等,注意铁在常温下在浓硝酸中的钝化,题目难度中等.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
. .
.
 ;吡啶与混酸(浓硝酸与浓硫酸混合物)在加热条件下,发生硝化反应生成氮原子间位的一取代物的化学方程式为
;吡啶与混酸(浓硝酸与浓硫酸混合物)在加热条件下,发生硝化反应生成氮原子间位的一取代物的化学方程式为 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 28g N2含有的氮原子数目为NA | |
| B. | 常温常压下,22.4L Cl2含有的分子数目为NA | |
| C. | 1molNa变为Na+时失去的电子数目为NA | |
| D. | 1L 1mol•L-1K2CO3溶液中含有的钾离子数目为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 30% | B. | 40% | C. | 50% | D. | 60% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2:1 | B. | 1:2 | C. | 1:1 | D. | 2:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 图为一个原电池,完成下列问题:
图为一个原电池,完成下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.104 | 0.111 | 0.066 |
| 主要化合价 | +2 | +3 | +6、-2 | +2 | -2 |
| A. | L与T形成的化合物属于共价化合物 | |
| B. | M的最高价氧化物的水化物具有两性 | |
| C. | T、Q的氢化物常温常压下均为无色气体 | |
| D. | L、M的单质与稀盐酸反应速率:M>L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com