
【题目】把含硫酸铵和硝酸铵的混合液a L分成两等份.一份加入含b mol NaOH的溶液并加热,恰好把NH3全部赶出;另一份需消耗c mol BaCl2才能使SO42-完全沉淀,则原溶液中NO3-的物质的量浓度为( )
A.![]() B.
B. ![]() C.
C. ![]() D.
D. ![]()
 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案科目:高中化学 来源: 题型:
【题目】已知蓝铜矿的主要成分是2CuCO3·Cu(OH)2,受热易分解。铝土矿的主要成分是Al2O3、Fe2O3、SiO2。已知:NaAlO2+CO2+H2O = Al(OH)3↓+NaHCO3,根据下列框图转化回答问题:
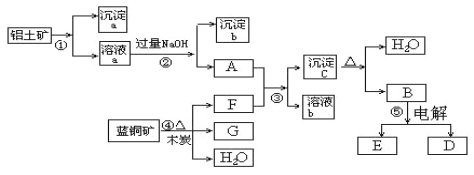
(1)写出②的离子方程式:_________________________、_____________________________。
(2)沉淀a、c化学成分分别是: ___________________、_________________________
(3)请写出检验沉淀b中所含有阳离子的实验方法_____________________________________________________________。
(4)洗涤沉淀c的实验操作方法是_______________________________________________________;加热沉淀c应放在___________(容器)中进行。
(5)经过④、⑤步反应得到铜和金属铝,写出反应的化学方程式:________________________________________________、____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将6.4gCu与足量的浓硫酸在加热条件下充分反应。
(1)把反应后的溶液稀释至500mL,取出50mL,向其中加入足量的BaCl2溶液,得到沉淀4.66g,则稀释后所得溶液中SO42-的物质的量浓度为_____________。
(2)把产生的气体缓缓通入100 mL a mol/L的NaOH溶液中,若反应物均无剩余,则a的取值范围是___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列A~I九种中学化学常见的物质之间的转化关系如图所示,已知A为固态非金属单质,B在实验室常用作气体干燥剂,D为常见液体,常温下C、E、F都是无色气体,E能使酸性高锰酸钾溶液褪色,G是侯氏制碱法的最终产品。

(1)B的名称为________,图中淡黄色固体物质中的阴、阳离子个数比为_________。
(2)E转变为H和I的离子方程式是___________________,体现了E的_______性。
(3)E能使酸性高锰酸钾溶液褪色的离子方程式为______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘是人体中不可缺少的元素,为了防止碘缺乏,现在市场上流行一种加碘盐,就是在精盐中添加一定量的KIO3进去。某研究小组为了检测某加碘盐中是否含有碘,查阅了有关的资料,发现其检测原理是:
KIO3+5KI+3H2SO4=3I2+3H2O+3K2SO4
(1)用双线桥表示该反应中电子转移的方向和数目,该反应中还原产物与氧化产物的物质的量之比是____,0.2mol KIO3参加反应时转移电子____mol。
(2)实验结束后分离I2和K2SO4溶液所用的试剂是_______。
A.CCl4 B.酒精 C.Na2SO4溶液 D.食盐水
所用的分离方法是______,所用主要玻璃仪器是_____________。
(3)上面实验中用到一定物质的量浓度的稀硫酸,若配制1mol/L的稀硫酸溶液480mL,需用18mol/L浓H2SO4____mL,配制中需要用到的主要玻璃仪器是(填序号)______。
A.100mL量筒 B.托盘天平 C.玻璃棒 D.100mL容量瓶 E.50mL 量筒 F.胶头滴管 G.烧杯 H.500mL容量瓶
(4)下面操作造成所配稀硫酸溶液浓度偏高的是_______________
A.溶解后溶液没有冷却到室温就转移
B.转移时没有洗涤烧杯、玻璃棒
C.向容量瓶加水定容时眼睛俯视液面
D.用量筒量取浓硫酸后洗涤量筒并把洗涤液转移到容量瓶
E.摇匀后发现液面低于刻度线,又加蒸馏水至刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一容积可变的密闭容器中,反应aA(g)![]() bB(g)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原来的60%,则
bB(g)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原来的60%,则
A. 平衡向逆反应方向移动了 B. 物质A的转化率减少了
C. 物质B的质量分数增加了 D. 化学计量数关系a>b
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)![]() CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
t℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K =_________________________________。
(2)该反应的正反应为____________反应(填“吸热”、“放热”)。
(3)某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为______________℃。此温度下加入1molCO2(g)和1molH2(g),充分反应,达到平衡时,CO2的转化率为__________。
(4)在800 ℃时,发生上述反应,某一时刻测得容器内各物质的浓度分别为c(CO2)为2mol/L ,c(H2)为1.5mol/L,c(CO)为1mol/L, c(H2O)为3mol/L,则正、逆反应速率的比较为υ正________υ逆 。(填“>”、“<”或“=”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高温下,某反应达到平衡,平衡常数![]() 。恒容时,温度升高,H2浓度减小,下列说法正确的是
。恒容时,温度升高,H2浓度减小,下列说法正确的是
A. 该反应的焓变为正值
B. 恒温恒容下,增大压强,H2浓度一定减小
C. 升高温度,逆反应速率减小
D. 该反应化学方程式为CO+H2O![]() CO2 + H2
CO2 + H2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com