
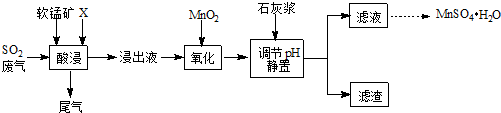
分析 由流程可知,软锰矿主要成分MnO2,杂质金属元素Fe、Al等,制备MnSO4•H2O,可以加硫酸溶解后,得到浸出液中阳离子主要有Mn2+、Fe2+、Al3+等,加入二氧化锰,将亚铁离子氧化成铁离子,调节pH,将铁离子、铝离子转化为沉淀,则滤渣为Fe(OH)3、Al(OH)3,滤液为溶液MnSO4,经过蒸发浓缩、趁热过滤可得MnSO4•H2O,
(1)本实验要制备MnSO4•H2O,为了不引入新杂质,可以用硫酸溶解;
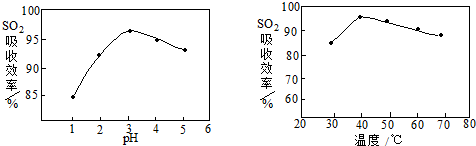
(2)根据图中SO2的吸收效率最高的点确定酸浸适宜的条件;
(3)流程中“氧化”步骤是用二氧化锰将铁离子氧化成铁离子,同时生成锰离子;
(4)检验Fe3+可以用KSCN溶液;
(5)根据反应①2Mn2++O2+4OH-=2MnO(OH)2(反应很快);②MnO(OH)2+2I-+4H+=Mn2++I2+3H2O;③I2+2S2O32-=S4O62-+2I-,可得关系式O2~4 S2O32-,利用关系式根据Na2S2O3的物质的量可以求得O2的物质的量,进而计算出水样中溶解氧的浓度.
解答 解:(1)本实验要制备MnSO4•H2O,为了不引入新杂质,可以用硫酸溶解,故选b;
(2)根据图可知pH为3左右SO2的吸收率高,温度为40℃左右SO2的吸收率高,所以选择的条件为pH控制在3左右,温度控制在40℃左右,
故答案为:pH控制在3左右,温度控制在40℃左右;
(3)流程中“氧化”步骤是用二氧化锰将铁离子氧化成铁离子,同时生成锰离子,反应主离子方程式为MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O,
故答案为:MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O;
(4)检验Fe3+可以用KSCN溶液,所以检验Fe3+是否除尽的最佳方法是取上层清液少许,向其中滴加少许KSCN溶液,若溶液未出现血红色,则Fe3+除尽,
故答案为:取上层清液少许,向其中滴加少许KSCN溶液,若溶液未出现血红色,则Fe3+除尽;
(5)由题意可知n(S2O32-)=5.00×10-3mol•L-1 ×12.0 mL=6.00×10-5 mol,根据反应①2Mn2++O2+4OH-=2MnO(OH)2(反应很快);②MnO(OH)2+2I-+4H+=Mn2++I2+3H2O;③I2+2S2O32-=S4O62-+2I-,可得关系式:
O2 ~4 S2O32-,
1 mol 4 mol
n(O2) 6.00×10-5 mol
n(O2)=1.50×10-5 mol
所以水样中溶解氧的浓度=1.50×10-5 mol×32 g•mol-1÷100mL=4.80 mg•L-1,
答:水样中溶解氧的浓度为4.80 mg•L-1.
点评 本题考查学生对元素及其化合物的主要性质的掌握、书写电极反应方程式、阅读题目获取新信息能力、对工艺流程的理解等,难度中等,需要学生具备扎实的基础与综合运用知识、信息分析解决问题能力.


科目:高中化学 来源: 题型:解答题
 如图是用浓硝酸、铜片、水等试剂探究浓、稀硝酸的强氧化性并观察还原产物的实验装置.
如图是用浓硝酸、铜片、水等试剂探究浓、稀硝酸的强氧化性并观察还原产物的实验装置.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5 | B. | 4 | C. | 3 | D. | 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 装置C中发生反应:2NaClO3+SO2═2ClO2+Na2SO4 (Ⅰ)
装置C中发生反应:2NaClO3+SO2═2ClO2+Na2SO4 (Ⅰ)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K与F | B. | Na与F | C. | Al与Cl | D. | Mg与Cl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | AlCl3溶液和Al2(SO4)3溶液加热、蒸发、浓缩、结晶、灼烧,所得固体的成分相同 | |
| B. | 配制FeCl3溶液时,将FeCl3固体溶解在硫酸中,然后再用水稀释到所需的浓度 | |
| C. | TiCl4+(x+2)H2O(过量)?TiO2•xH2O↓+4HCl 工业上利用该反应制备TiO2纳米粉 | |
| D. | 泡沫灭火器中常使用的原料是碳酸钠和硫酸铝 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com