
| A. | 通常状况下,1mol/L Na2CO3溶液中含钠离子数为2NA | |
| B. | 4℃时,18g 2H216O中含有共用电子对数为2NA | |
| C. | 1mol N5+含有的电子数为34NA | |
| D. | 1mol NH4+中含有的中子数为10NA |
分析 A.溶液体积不知;
B.每个2H216O含有2对共用电子对,根据n=$\frac{m}{M}$计算2H216O的物质的量,再根据N=nNA计算共用电子对数目;
C.N5+的电子数为34;
D.1mol NH4+中含有7个中子.
解答 解:A.溶液体积不知不能计算微粒数,故A错误;
B.18g2H216O中含有共用电子对数为$\frac{18g}{20g/mol}$×2×NAmol-1=1.8NA,故B错误;
C.1mol N5+含有的电子数为34NA,故C正确;
D.1mol NH4+中含有的中子数为7NA,故D错误.
故选C.
点评 本题考查阿伏加德罗常数的相关计算,题目难度不大,注意物质的组成、结构、性质以及物质存在的外界条件和聚集状态等问题.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:多选题
| A. | 当滴入20mL NaOH溶液时:2c(SO42-)=c(NH3•H2O)+c(NH4+) | |
| B. | 当滴入30mL NaOH溶液时(pH>7):c(NH4+)>c(NH3•H2O)>c(OH-)>c(H+) | |
| C. | 当溶液呈中性时:c(NH4+)>c(SO42-)>c(Na+)>c(H+)=c(OH-) | |
| D. | 整个反应过程中:c(H+)+c(Na+)+c(NH4+)=c(OH-)+2c(SO42-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 工业上用FeCl3溶液吸收废气中的H2S气体,离子方程式为:Fe3++H2S=Fe2++S↓+2H+ | |
| B. | 在0.1 mol/L的AlCl3溶液中,Na+、K+、SO42-、HCO3-均可大量共存 | |
| C. | 常温下pH=4的NaHC2O4溶液中:c(H2C2O4)>c(C2O42-) | |
| D. | 已知25℃时NH4CN溶液显碱性,则25℃时的电离平衡常数K(NH3•H2O)>K(HCN) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应后生成NO的体积为28 L | B. | 所得溶液中c(Fe2+):c(Fe3+)=1:1 | ||
| C. | 所得溶液中c(NO3-)=2.75 mol/L | D. | 所得溶液中的溶质只有FeSO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 增大 | B. | 减小 | C. | 不变 | D. | 无法判断 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al比Cu活泼,Al为负极,Cu极上析出NO2 | |
| B. | Cu比Al活泼,Cu为负极,Al极上析出Cu | |
| C. | Cu为负极,电极反应:Cu-2e-═Cu2+ | |
| D. | Al为正极,电极反应:2H++2e-═H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
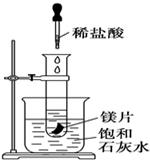 如图所示,把试管放入盛有25℃饱和澄清石灰水的烧杯中,试管中开始放入几小块镁片,再用滴管滴入10mL盐酸于试管中,试回答下列问题:
如图所示,把试管放入盛有25℃饱和澄清石灰水的烧杯中,试管中开始放入几小块镁片,再用滴管滴入10mL盐酸于试管中,试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
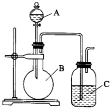 某同学设计如图装置,探究非金属性质变化规律.
某同学设计如图装置,探究非金属性质变化规律.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com