
现有X、Y、Z、W四种短周期元素原子序数依次增大,其原子半径及主要化合价如下表所示。又知X与Y、Z与W分别位于同一周期,Y、W处于同一主族。
| 元素 | X | Y | Z | W |
| 原子半径/nm | 0.077 | 0.074 | 0.186 | 0.102 |
| 主要化合价 | -4,+4 | -2 | +1 | -2,+6 |
请回答:
1.X位于元素周期表的 ,画出Z原子结构示意图 ,
Z2W是离子晶体,写出其电子式 。
2.X单质能与某酸(H2WY4)的浓溶液发生反应,产物有XY2、WY2和水,
其反应的化学方程式为 ;
3.Z2Y2可与XY2发生反应可给潜水艇供氧,其反应的化学方程式为 ;
若反应中转移电子数为3.01×1023,则所得气体产物的体积是 (标准状况)。
4.Y、Z、W三种元素可组成质量比为5.75 :8 : 4的某种化合物。实验室检验该化合物中所含阴离子的操作方法及有关实验现象是:取少量含该阴离子的溶液, ,则证明原溶液中含有该阴离子。
1.二周期ⅣA族 、
2.C + 2H2SO4(浓)CO2↑+ 2SO2 ↑+ 2H2O
3.2Na2O2+ 2CO2 = 2Na2CO3 + O2↑ 5.60L
4.滴加少量的硝酸钡溶液(盐酸和氯化钡溶液),如产生白色沉淀
解析:考查元素周期表的结构和元素周期律的应用。根据化合价可知判断X、Y、Z、W
四种短周期元素分别属于第ⅣA、ⅥA、IA、ⅥA。因为同周期元素自左向右原子半径逐渐减小,同主族元素自上而下原子半径逐渐增大,所以X、Y、Z、W四种短周期元素分别为C、O、Na、S。过氧化钠和CO2的反应中,过氧化钠既作氧化剂,还是还原剂。根据方程式可判断每生成1mol氧气,反应中就转移2mol电子。所以当反应中转移电子数为3.01×1023,所得氧气是0.25mol,其体积是22.4L/mol×0.25mol=5.6L。O、Na、S三种元素的质量比为8 :5.75 : 4,则其原子个数之比是![]() ︰
︰![]() ︰
︰![]() =4︰2︰1,所以该化合物是硫酸钠。检验SO42-可用盐酸酸化的氯化钡溶液即可。
=4︰2︰1,所以该化合物是硫酸钠。检验SO42-可用盐酸酸化的氯化钡溶液即可。


科目:高中化学 来源: 题型:
| 元素 | X | Y | Z | W |
| 原子半径/nm | 0.186 | 0.074 | 0.102 | 0.077 |
| 主要化合价 | +1 | -2 | -2,+6 | -4,+4 |
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:


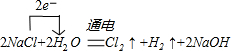
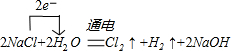
查看答案和解析>>
科目:高中化学 来源: 题型:
(10分)现有X.Y.Z.W四种常见的含氧酸,其成酸元素分属周期表中短周期的第ⅣA族到第 ⅦA。将四种含氧酸溶液分别进行光照或微热测得如下数据(其中Q为不确定的物质):
| 含氧酸 | X | Y | Z | W |
| 含氧酸质量/g | 25.2 | a | 3.1 | 10.5 |
| 生成物U/g | 3.2 | / | / | 3.2 |
| 生成物V/g | 3.6 | 0.9 | 0.9 | / |
| 生成物Q/g | 18.4 | 3.2 | b | c |
根据中学所学知识回答下列问题:
(1)上表中含氧酸名称:Z ,W ,生成物名称:U ,V 。
(2)上表中数据:a为 ,b为 ,c为 。
(3)将X的稀溶液加入Y中,反应的离子方程式是 。
(4)对W的水溶液光照一段时间后,溶液的pH (填“增大”.“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源:2010年郑州市高二下学期期末考试化学试题 题型:填空题
现有X、Y、Z、W四种短周期元素。
①X元素的单质在Y元素的单质中燃烧发出苍白色火焰,并生成气体A。
②Z元素的单质与A的水溶液反应又生成X元素的单质。
③Z元素的原子和Y元素的原子电子层数相同,且它们的最外层电子数之差的绝对值为奇数。
④W元素的原子核外有3个电子层,其最外层电子数等于电子层数。
请回答下列问题:
(1)X的元素符号为:_________;Z的元素名称是: 。(2分)
(2)A的电子式是 。(2分)
(3)Z的单质与A的溶液反应的离子方程式 。(2分)
(4)W的氧化物溶于NaOH中的化学方程式 。(2分)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com