
【题目】下列变化过程中,原物质分子内共价键被破坏,同时有离子键形成的是 ( )
A. 盐酸和NaOH溶液混合 B. 氯化氢溶于水
C. 溴化氢气体与氨气相遇反应 D. 锌和稀硫酸反应
科目:高中化学 来源: 题型:
【题目】某实验小组同学进行如下实验,以检验化学反应中的能量变化.请回答下列问题: 
(1)实验中发现,反应后①中的温度升高;②中的温度降低.由此判断铝条与盐酸的反应是热反应,Ba(OH)28H2O与NH4Cl的反应是热反应.反应过程(填“①”或“②”)的能量变化可用图2表示.
(2)现有如下两个反应: (A)NaOH+HCl=NaCl+H2O (B)2FeCl3+Cu=2FeCl2+CuCl2
以上两个反应能设计成原电池的是 , 负极材料为: , 电解质溶液为: , 负极的电极反应式为: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某固体酸性燃料电池以Ca(HSO4)2固体为电解质传递H+ , 其基本结构见图,电池总反应可表示为:2H2+O2=2H2O,下列有关说法正确的是( ) 
A.电子通过外电路从b极流向a极
B.每转移0.1mol电子,消耗1.12L的H2
C.H+由a极通过固体酸电解质传递到b极
D.b极上的电极反应式为:O2+2H2O+4e﹣═4OH﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙两化学兴趣小组安装两套如图1相同装置,用以探究影响H2O2分解速率的因素. 
(1)仪器b的名称: .
(2)甲小组有如下实验设计方案,请帮助完成下列填空.
实验编号 | 实验目的 | t℃ | 催化剂 | 浓度 |
甲组实验Ⅰ | 做实验参照 | 25 | 10mL 2%H2O2 | |
甲组实验Ⅱ | 探究浓度对速率的影响 | 25 | 10mL 5%H2O2 |
(3)甲、乙两小组得出如图2数据. ①由甲组实验得出的数据可知:浓度越大,H2O2分解速率(填“越快”、“越慢”);
②由乙组研究的酸、碱对H2O2分解影响因素的数据分析相同条件下,Na2O2和K2O2溶于水放出气体速率较快的是;
③乙组提出可以用BaO2固体与H2SO4溶液反应制H2O2 , 其化学反应方程式为;支持这一方案的理由是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种新型的乙醇电池,它用磺酸类质子溶剂.电池总反应为:C2H5OH+3O2→2CO2+3H2O,电池示意如图,下列说法正确的是( )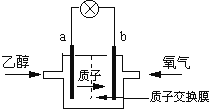
A.a极为电池的正极
B.电池工作时电流由a极沿导线经灯泡再到b极
C.电池负极的电极反应为:4H++O2+4e﹣=2H2O
D.电池工作时,1mol乙醇被氧化时就有12mol电子转移
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某100mL溶液可能含有Na+、NH4+、Fe3+、CO32﹣、SO42﹣、Cl﹣中的若干种,取该溶液进行连续实验,实验过程如图:(所加试剂均过量,气体全部逸出)下列说法不正确的是( ) 
A.原溶液一定存在CO32﹣和SO42﹣ , 一定不存在Fe3+
B.原溶液一定存在Cl﹣ , 可能存在Na+
C.原溶液中c(Cl﹣)≥0.1molL﹣1
D.若原溶液中不存在Na+ , 则c(Cl﹣)<0.1molL﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知亚硫酸钠在空气中能被氧气氧化生成硫酸钠.某同学为探究Na2SO3溶液是否发生变质,设计如下实验测定1.0molL﹣1Na2SO3溶液的实际浓度. 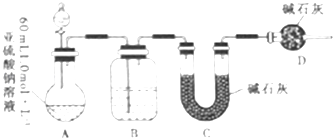
(1)分液漏斗中应加入足量的下列哪种试剂?(填选项)
A.浓硝酸
B.65%硫酸
C.浓盐酸
(2)实验前后C装置增重3.2g,则测得Na2SO3溶液的物质的量浓度为molL﹣1 .
(3)该实验装置还存在一个明显的缺陷是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中加入铝片有氢气产生,则该溶液中一定能大量共存的离子组是( )
A.Cl﹣、Fe3+
B.HCO3﹣、Al3+
C.Ba2+、SO42﹣
D.Na+、SO42﹣
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com