
(18分)氯气在科技、生产中应用广泛。
(1)工业上常用熟石灰和氯气反应制取漂白粉,化学方程式是___ 。
(2)实验室用MnO2与浓盐酸反应制取氯气的过程中,可用NaOH溶液吸收尾气,下列试剂也可用于吸收氯气的是____(填字母)。
a.KI溶液 b.FeCl2溶液 c.KCl溶液
写出你选择的一种吸收试剂与Cl2反应的离子方程式:____ 。
也可用浓氨水吸收氯气,同时生成一种无污染的气体,反应的化学方程式是____ 。
(3)以粗盐为原料制备亚氯酸钠(NaClO2)的工艺流程如下

写出二氧化氯发生器中生成二氧化氯的离子方程式 。
(4)FeCl3在现代工业生产中应用广泛。某化学研究性学习小组模拟工业流程制备无水FeCl3,再用副产品FeCl3溶液吸收有毒的H2S。经查阅资料得知:无水FeCl3在空气中易潮解,加热易升华。他们设计了制备无水FeCl3的实验方案,装置示意图(加热及夹持装置略去)及操作步骤如下:

a.检验装置的气密性;
b.通入干燥的Cl2,赶尽装置中的空气;
c.用酒精灯在铁屑下方加热至反应完成;
d.在沉积的FeCl3固体下方加热
e.体系冷却后,停止通入Cl2,并用干燥的N2赶尽Cl2,将收集器密封。
请回答下列问题:
①装置D中FeCl2的作用是 ,写出检验FeCl3的离子方程式 。
②画出尾气吸收装置E并注明试剂。
③该组同学用装置D中的副产品FeCl3溶液吸收H2S,得到单质硫,FeCl3与H2S反应的离子方程式为________________ 。
(1)2Cl2 + Ca(OH)2 ==CaCl2 + Ca(ClO)2 +2H2O (2分)(2)ab (2分) Cl2 +2I- == 2Cl- + I2 或2Fe2+ + Cl2 ===2Fe3+ + 2Cl- (2分)3 Cl2 + 8NH3 == 6NH4Cl + N2 或 3Cl2 + 2NH3 == 6 HCl + N2 (2分)(3)2ClO3- + SO2 == 2ClO2 + SO42- (2分)(4)①吸收Cl2 (2分) Fe3+ + 3OH- == Fe(OH)3 ↓ 或 Fe3+ + 3SCN- == Fe(SCN)3 (2分)
②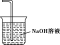 (2分) ③2Fe3++H2S===2Fe2++S↓+2H+ (2分)
(2分) ③2Fe3++H2S===2Fe2++S↓+2H+ (2分)
【解析】
试题分析:(1)熟石灰主要成分是Ca(OH)2,和氯气反应制取漂白粉,那么化学方程式是2Cl2 + Ca(OH)2 ==CaCl2 + Ca(ClO)2 +2H2O (2)利用Cl2有强氧化性也可以选用有还原性物质来吸收Cl2,A、B两种试剂都有还原性都可以吸收Cl2,任选一种物质写出它与Cl2反应的离子方程式,浓氨水吸收氯气,同时生成一种无污染的气体,根据参与反应的物质的原子种类,可以推出该气体是N2,根据两边原子种类和个数相同推出另一种产物是HCl,写出方程式3Cl2 + 2NH3 == 6 HCl + N2,如果NH3过量,NH3 与HCl生成NH4Cl则为3 Cl2 + 8NH3 == 6NH4Cl + N2(3)从流程图中可以看出是利用氯酸钠、二氧化、硫硫酸反应来制取二氧化氯,氯酸钠到二氧化氯,氯的化合价降低,所以发生了氧化还原反应,离子方程式为:2ClO3- + SO2 == 2ClO2 + SO42-(4)①根据实验的信息,FeCl3在B中冷凝变成了固体,进入到D、E装置主要是Cl2 、FeCl2溶液可以与Cl2反应,所以起到吸收Cl2所用,Fe3+的检验通常用KSCN溶液或者NaOH溶液,任选一个写出其离子方程式。② 尾气主要是Cl2有毒需要吸收通常用NaOH溶液来吸收,将Cl2通入到NaOH溶液中即可。 ③FeCl3溶液吸收H2S是利用了氧化还原反应,离子方程式为2Fe3++H2S===2Fe2++S↓+2H+
考点:常见的实验装置各部分的作用、氧化还原反应。


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源:2014-2015甘肃省高二上学期期末考试化学试卷(解析版) 题型:选择题
常温下,下列离子能使纯水中的H+离子数目增加的是
A.S2- B.CO32- C.NH4+ D.Br-
查看答案和解析>>
科目:高中化学 来源:2014-2015福建省福州市高一上学期期中化学试卷(解析版) 题型:选择题
火箭的主要燃料是偏二甲肼(用R表示)和四氧化二氮,在火箭发射时,两者剧烈反应产生大量气体并释放出大量的热,该反应的化学方程式为:R + 2N2O4 = 3N2 + 4H2O + 2CO2,下列叙述错误的是
A.此反应是氧化还原反应
B.反应瞬间产生大量高温气体,推动火箭飞行
C.在反应中N2O4做还原剂
D.R的分子式为C2H8N2
查看答案和解析>>
科目:高中化学 来源:2014-2015福建省福州市高一上学期期中化学试卷(解析版) 题型:选择题
已知硫、二氧化硫、三氧化硫三种物质的质量比为2:4:5,它们的物质的量之比为
A.2:4:5 B.1:1:1 C.5:4:2 D.1:2:3
查看答案和解析>>
科目:高中化学 来源:2014-2015福建省高二上学期期中化学(理)试卷(解析版) 题型:选择题
钡在氧气中燃烧时得到一种钡的氧化物晶体,结构如图所示,有关说法不正确的是

A.该晶体属于离子晶体
B.晶体的化学式为Ba2O2
C.该晶体晶胞结构与NaCl相似
D.与每个Ba2+距离相等且最近的Ba2+共有12个
查看答案和解析>>
科目:高中化学 来源:2014-2015福建省高二上学期期中化学(理)试卷(解析版) 题型:选择题
下列各组物质发生变化时,所克服的粒子间作用力属于同种类型的是
A.氯化铵晶体和二氧化硅的熔化 B.碘和干冰的升华
C.氯化钾和氯化氢溶解于水 D.溴和汞的气化
查看答案和解析>>
科目:高中化学 来源:2014-2015福建省高二上学期期中化学(理)试卷(解析版) 题型:选择题
下列基态原子的电子排布式中,其未成对电子数最多的是
A.1s22s22p63s23p63d64s2 B.1s22s22p63s23p64s1
C.1s22s22p63s23p63d54s1 D.1s22s22p63s23p63d104s1
查看答案和解析>>
科目:高中化学 来源:2014-2015福建省高二上学期期末考试化学试卷(解析版) 题型:选择题
一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示,下列描述正确的是

A.该反应中,X和Y是生成物,Z是反应物
B.反应开始到10s,用Z表示的反应速率为0.158mol/(L·s)
C.反应开始10s,Y的转化率为79.0%
D.反应的化学方程式为:X(g)+ Y(g) Z(g)
Z(g)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com